Dieser Artikel wurde in Russisch zum Thema Zusammenwirkungen von wissenschaftlichen Disziplinen geschrieben und in der Zeitschrift Rostocker Wissenschaftshistorische Manuskripte, Heft 10 (1984), S. 45-61 publiziert, ohne dass die deutsche Übersetzung dem Verfasser vor dem Druck gezeigt wurde. Leider enthielt jene Übersetzung eine Vielzahl von Sinnentstellungen und Fehlern, teilweise groben. Hier sind diese korrigiert worden. Außerdem hat der Verfasser einige zusätzliche Literaturhinweise hinzugefügt.
1. Einleitung
Die chemische Thermodynamik ist eine typische Grenzdisziplin, ein Produkt interdisziplinärer Forschung auf den Gebieten der Physik und Chemie. Dieses Resultat war in einer längeren Periode vielfältiger Wechselwirkungen zwischen Physik und Chemie bzw. zwischen einzelnen Richtungen innerhalb dieser Gebiete bereitet worden. Im weiteren sollen die hier angedeuteten Prozesse im großen und ganzen betrachtet werden.
2. Thermodynamik
2.1. Mechanik
Zu den Quellen der Thermodynamik gehört die Mechanik. Dieses älteste Gebiet menschlichen Wissens hat der Physik und der Naturwissenschaft überhaupt viele Ideen und Begriffe allgemeiner Bedeutung gegeben. Die Naturwissenschaft, die zum Ende des 19. Jahrhunderts zu mechanistischer Naturerklärung neigte, wurde nachhaltig von der Denkweise der Mechanik geprägt. Die Erweiterung von Begriffen der Mechanik auf andere physikalische Erscheinungen ist eine der charakteristischen Seiten der Physikgeschichte, insbesondere der Geschichte der Thermodynamik.
Die Mechanik stellt andererseits auch für die Chemie der neueren Zeit einen wichtigen Teil des wissenschaftlichen und sogar des kulturellen Kontextes dar, so dass sich, wie wir noch sehen werden, wichtige Vorstellungen der theoretischen Chemie des 18. und 19. Jahrhunderts durch Übertragung von Begriffen der Mechanik auf das chemische Boden herausgebildet haben. Zwei Grundbegriffe prägen die ganze Geschichte der Mechanik: Der Begriff der Bewegung und der des Gleichgewichts.
Die Dynamik hat das Gesetz von der Erhaltung der lebenden Kräfte, die Statik die Lehre vom Kräftegleichgewicht hervorgebracht. Darin besteht der hauptsächliche, jedoch nicht der einzige Beitrag der Mechanik bei der Vorbereitung der Thermodynamik.
Die relative Einfachheit der untersuchten Objekte erleichterte die mathematische Behandlung mechanischer Probleme, so dass sich gegen Ende des 18. Jahrhunderts die Mechanik zu einer logisch konsistenten Disziplin mit einem gut ausgearbeiteten formalen Apparat entwickelt hatte. Mit dieser „Mathematisierung" der Mechanik bildeten sich die physikalischen Begriffe „System" (die auf bestimmte Weise begrenzte Gruppe von Körpern) und „Systemzustand" (die Gesamtheit der Größen, die in hinreichender Weise das Verhalten des Systems beschreiben) heraus. Der mathematische Apparat der Mechanik hatte parat Mittel und Verfahren, die später von den anderen physikalischen Wissenschaften übernommen wurden, so auch von der Thermodynamik (insbesondere solche Begriffe aus der theoretischen Mechanik wie „Arbeit" und „Potential").
An der Entstehung der Thermodynamik war die theoretische Mechanik je doch nicht mit ihrem ganzen theoretischen Reichtum beteiligt; denn der erste Beitrag der Mechanik zur Entstehung der Thermodynamik, der Begriff der Arbeit, war von Ingenieur-Praktikern zur Kennzeichnung der Effektivität der Maschine geschaffen worden. Tatsächlich befand sich also nicht die theoretische Mechanik, die ein in sich geschlossenes, sich selbst genügendes Wissenssystem darstellte, sondern die praktische, die Ingenieurmechanik, „an der Grenze" der Wärmelehre.
2.2. Wärmelehre
„ Die wichtigsten Begriffe, die man für die Beschreibung von Wärmephänomenen braucht sind Temperatur und Wärme. Es hat unglaublich lange gedauert, bis die Naturwissenschaft überhaupt erst einmal so weit war, zwischen diesen beiden Begriffen zu unterscheiden, doch ging es dann rasch vorwärts" [1]. Das genannte Ereignis gehört zum dritten Viertel des 18. Jahrhunderts und ist vor allem mit dem Namen J. Black verbunden. Die begriffliche Trennung von „Temperatur" und „Wärmemenge" mit Hilfe der Vorstellung vom „Gleichgewicht der Wärme " [2], die Entdeckung der Wärmekapazität der Körper und der latenten Wärme beim Schmelzen und Verdampfen brachte die Erforschung der Wärmephänomene erheblich voran. Diese Erfolge erwiesen sich jedoch nach einem Ausdruck von Black als „äußerst ungünstig“ im Hinblick auf das Begreifen der Wärme als Bewegung. Während die Wärrnestofftheorie eine erfolgversprechende Grundlage für die weitere quantitative Erforschung der Wärmeerscheinungen bildete, bot die kinetische Auffassung damals keine solchen Möglichkeiten.
Die Experimente und Ideen von B. Rumford (1798), die als Vorbereitung der dynamischen Wärmetheorie gelten, riefen die Kritik der Anhänger des Wärmestoffs (J. Henry, C. L. Berthollet, P.S. Laplace, J. B. Biot) hervor; von den meisten Zeitgenossen blieben sie einfach unbemerkt und unbeachtet: Der Wärmestoff blieb ein brauchbarer Begriff. Mehr noch: Obwohl fast überlebt, diente die Wärmestofftheorie noch als Grundlage für eine der größten Leistungen in der Physikgeschichte, für die Aufstellung des Carnot-Prinzips.
2.3. „Die bewegende Kraft der Wärme“
Das 18. Jahrhundert, die Zeit der isolierten Entwicklung der Wissenschaften, hinterließ die Mechanik und die Wärmelehre als scharf voneinander abgegrenzte Bereiche der Physik. „Wie allumfassend die mechanischen Theorien gewesen sein mochten, in keinem Fall können sie auf Wärmeeffekte angewandt werden. Die Wärme gehört zu einer besonderen Kategorie von Erscheinungen, die nicht durch die Gesetze der Bewegung und des Gleichgewichts erklärt werden können", schrieb J. Fourier 1822 [3].
Inzwischen hatte die Praxis schon längst die Grenze überschritten, die für die Theorie unüberwindbar geblieben war. Das 19. Jahrhundert begann als „Jahrhundert des Dampfes", und jeder Dampfantrieb demonstrierte tatsächlich den Zusammenhang zweier Erscheinungen, die man nicht miteinander in Verbindung bringen konnte. Indes bedurfte es erst des Genies eines S. Carnot, um die theoretische Bedeutung dieses Faktums zu begreifen und erstmals die Frage über die bewegende Kraft der Wärme und die zur Entwicklung dieser Kraft geeigneten Maschinen“ zu stellen [4].
Ausgehend davon, dass ein perpetuum mobile unmöglich ist und die erzielte Bewegung in Maschinen durch die „Wiederherstellung des Gleichgewichts des Wärmestoffs“ gesichert wird, formulierte Carnot das Gesetz: „Die bewegende Kraft der Wärme ist unabhängig von dem Agens, welches zu ihrer Gewinnung benutzt wird, und ihre Menge wird einzig durch die Temperaturen der Körper bestimmt, zwischen denen in letzter Linie die Überführung des Wärmestoffs stattfindet." [4, p. 96]. Außer dieser grundlegenden Leistung enthält Carnots Werk noch weitere Erkenntnisse. Carnot entwickelte die Begriffe isothermischer, adiabatischer, reversibler und Kreisprozesse; er schuf die erste thermodynamische Methode, nämlich die Betrachtung des reversiblen Kreisprozesses; er führte weiterhin die universelle Funktion der Temperatur ein, aus der der Begriff der absoluten Temperatur abgeleitet wurde, und stellte als erster die Zustandsgleichung des idealen Gases auf. Ebenso führte er das ideale Gas als Standardstoff in die Wärmetheorie ein.
Im Werk Carnots und in Arbeiten seiner Nachfolger (B. Clapeyron, 1834; W. Thomson, 1848-1850; J. Thomson, 1849) ist ein Fragenkomplex erarbeitet worden, der später den Inhalt des zweiten Hauptsatzes der Thermodynamik darstellt.
2.4. Erhaltung der Energie
Obgleich die Vorgeschichte des Energiesatzes „ihren Ausgang bei Descartes nimmt, falls er nicht bis auf Salomon zurückgeht" (Maxwell), war es erst im 19. Jahrhundert möglich, diesen Satz zu formulieren.
Entscheidend für seine Vorbereitung war die Sammlung von Daten über unterschiedliche „Naturkräfte" in der Physik, Chemie und Biologie und ihre Wechselwirkung. Hinzu kommt, dass die Wärmemaschinen (Dampfschiffe und Dampflokomotiven) Einzug ins tägliche Leben hielten. Die „Kräfte"umwandlung fand in das Weltbild der Naturforscher wie von selbst Eingang. Deshalb bewegt die Wissenschaft der 30er und bis Anfang der 40er Jahre des 19. Jahrhunderts buchstäblich die Vorahnung vom Gesetz der Erhaltung und Umwandlung der Energie. Man kann viele Autoren (M. H. Jacobi, E. Lenz, J. Liebig, Fr. Mohr, M. Faraday, M. Séguin) anführen, die auf die eine oder andere Weise bis zu diesem Gesetz vorgedrungen sind.
In der Theorie der Wärme ging es jedoch nur stockend voran. Die Wärme wurde zwar als „Kraft" anerkannt, ohne das dies aber zur Ersetzung des Wärmestoffs durch eine Bewegungsform geführt hatte.
Als erster fand S. Carnot heraus [4, p. 248], dass „die Schaffung für diese Einheit bewe¬gender Kraft die Aufwendung von 2,70 Wärmeeinheiten erfordert." (Das entspricht 370 kgm/kcal – dergleichen Zahl, die 1842 R. Mayer und 1843 L. Kolding angegeben hatten); indes wurde diese Entdeckung Carnots erst 1878 bekannt. Die Aufstellung des Äquivalenzprinzips zwischen Wärme und Arbeit und des Gesetzes der Erhaltung und Umwandlung der Energie ist bekanntlich mit dem Namen von R. Mayer (1842), J. P. Joule (1843) und H. Helmholtz (1847) verbunden.
Es ist zu betonen, dass Beiträge von der Seite der chemischen Forschungen, besonders in der Thermochemie und Elektrochemie, aber auch in der physiologischen Chemie, ebenso bedeutend waren, wie Beiträge von der Seite der Physik und der Technik. Insbesondere war das große Werk Joules „aus einem chemischen Programm entstanden“ [5].
2.5. Mechanische Wärmetheorie
Die Ablösung der Wärmestofftheorie zog auch Zweifel am Carnotschen Prinzip selbst oder doch wenigstens an den Voraussetzungen, aus denen es abgeleitet worden war, nach sich. Jetzt konnte die „bewegende Kraft" des Wärmeauftriebs unmittelbar selbst durch das Faktum der Umwandlung der Wärme des heißen Körpers in Arbeit erklärt werden, und die bestehenden Annahmen über die Wärmeübertragung vom heißen zum kalten Körper verloren ihre Grundlage. Es entstand ein Widerspruch zwischen zwei Vorstellungen: Begibt sich die Wärme bei der Arbeitsleistung „wie das Wasser auf einer Mühle, welches nach getaner Arbeit noch vorhanden ist, nur auf einem tieferen Niveau" oder verhält sich die Wärme „wie die Kohle, welche beim Heizen der arbeitenden Dampfmaschine verbraucht wird" [6].
Diese Schwierigkeit hat Carnot selbst gesehen. Als er die Umwandlung von Wärme in Arbeit bei der Wärmeübertragung von einem Körper A auf einen Körper B untersucht hatte, überlegte er, ob es vielleicht ein Mittel gäbe, „mehr Wärme in mechanische Arbeit umzusetzen, sie also daher zu veranlassen, in geringerer Menge auf den Körper B überzugehen? Oder wäre es sogar möglich, die Wärme vollständig zu verbrauchen, so dass keine Wärmeübertragung auf den Körper B stattfindet? Wenn dies zuträfe, so könnte man eine bewegende Kraft, ohne Brennstoff zu verwenden, durch die einfache Ausnutzung der Körperwärme hervorbringen“ [4, p. 246]. Carnot dachte wohl hier schon über eine neue Begründung seines Prinzips nach und fragte sich, ob wohl so etwas möglich sei, was später „perpetuum mobile II. Art" genannt wurde. Die Größe der Schwierigkeit wird im Lichte neu erschlossener historischer Fakten insbesondere verständlich. Erst neuerdings wurde nachgewiesen [7], dass die zitierten Manuskripte Camots zum gleichen Zeitpunkt wie seine „Réflexionen" entstanden. Folglich tauchte vor Carnot der erwähnte Widerspruch eben während seiner Arbeit an den „Reflexionen" auf, und er war zumindest in dieser Zeit nicht in der Lage, ihn zu überwinden. Er war also gezwungen, zwischen zwei Möglichkeiten zu wählen, von denen die eine dem ersten, die andere dem zweiten Hauptsatz der Thermodynamik entsprach.
Ein Viertel Jahrhundert später stand W. Thomson vor dem gleichen Dilemma. Joule bestand in dieser Zeit darauf, das Carnot-Prinzip abzulehnen, W. Thomson sah jedoch bei einem solchen Verzicht voraus „unzählbare andere Schwierigkeiten, die ohne weitere experimentelle Forschung und ohne einen vollständigen Umbau der Wärmetheorie von ihren Grundlagen aus unüberwindbar werden" [8].
Neue Experimente wurden jedoch nicht erforderlich. Im folgenden Jahr (1850) zeigte R. Clausius, dass ein qualvolles Dilemma eigentlich nicht existiert: „…denn es kann bei der Erzeugung von Arbeit sehr wohl beides stattfinden, dass eine gewisse Wärmemenge verbraucht und eine andere von einem warmen zu einem kalten Körper überführt wird, und beide Wärmemengen können zu der erzeugten Arbeit in bestimmter Beziehung stehen" [9]. Die erste dieser Erscheinungen wird durch das Prinzip der Äquivalenz zwischen Wärme und mechanischer Arbeit bestimmt, die zweite durch das Carnotsche Prinzip. Die Vereinigung beider Prinzipien zu einer ungeteilten Theorie wurde zum Wendepunkt im Verständnis des Satzes von der Erhaltung der Energie: Bislang existierte noch kein einheitliches Bild aller physikalischen Erscheinungen einschließlich der Wärmeerscheinungen, das keine Widersprüche in sich barg.
Während der nächsten eineinhalb bis zwei Jahrzehnte sind durch die Arbeiten von R. Clausius, W. Thomson und ihrer Nachfolger die gedanklichen Voraussetzungen bzw. Ausgangsideen für eine neue Wissenschaftsdisziplin mit eigenen Grundgesetzen, die mit den Begriffen Energie, Entropie, absolute Temperatur arbeiten, und mit eigenen Methoden entwickelt worden. Ihrem Inhalt nach war die Thermodynamik der 60er bis Anfang der 70er Jahre des 19. Jahrhunderts gerade das, worauf ihre Bezeichnung hinwies, die Lehre von den Wechselbeziehungen zwischen Wärme und Arbeit. Sie befasste sich mit dem Zusammenhang von „kalorischen" und „thermischen" Eigenschaften der Körper, vorrangig der Gase und Flüssigkeiten, während es in ihrem angewandten Bereich um Fragen der Effektivität der Wärmemaschinen ging.
Die Allgemeinheit der Ausgangsprämissen sicherte aber Möglichkeiten, den Anwendungsbereich auszudehnen. Die Hauptereignisse der Entwicklung der Thermodynamik in den verbleibenden Jahrzehnten des 19. Jahrhunderts sind mit ihrer Anwendung auf die Chemie verbunden.
3. Chemische Mechanik
3.1. Affinität und Affinitätskraft
„ Nur erst seitdem man die Verwandtschaft für die Ursache aller Verbindungen anerkannt hat, konnte die Chemie als eine Wissenschaft angesehen werden, welche wenigstens anfing, allgemeine Gesetze zu haben“ [10].
Die ersten Erfolge der Affinitätslehre in der Chemie der neueren Zeit bestanden in der Befreiung von den anthröpomorphen Vorstellungen der Antike und ihrem Ersetzen durch einfache und anschauliche Modelle (R. Descartes, R. Boyle, N. Lemery). Nach Lemery beispielsweise werden die schweren Teilchen des im Königswasser gelösten Goldes durch die „dicken und starken“ Teilchen des Königswassers gestützt und vom Ausfallen gehindert (so etwa, wie Nägel im Brett) [11]. Mit der Entstehung der Newtonschen Mechanik wurden die naiven Schemata durch die Konzeption der Anziehungskraft zwischen Stoffen nach und nach abgelöst [12].
Vom Beginn bis in die 70erJahre des 18. Jahrhunderts bestimmte die allmähliche Übertragung des Kraftbegriffes aus der Mechanik auf die Chemie die Entwicklung der chemischen Affinitätsauffassung. Die Möglichkeit einer derartigen Übertragung ist mit der Aufstellung der ersten Affinitätstabelle eröffnet worden (E.-F. Geoffroy, 1718). Die Aufteilung der Stoffe A, B, C,. . . reihenweise in einer Anordnung, in welcher diese Stoffe im Stande sind, aus den Verbindungen AX, BX, CX,. . . mit einem dritten Stoff/X/ verdrängt zu werden, kennzeichnet die Anerkennung unterschiedlicher Affinitätsverhältnisse der Stoffe A, B, C zu dem Stoff X.
Die Interpretation der Unterschiede im Affinitätsverhältnis vom Standpunkt der „Kraft" bildete sich in der Zeit der 30er bis 60er Jahre des 18. Jahrhunderts heraus (H. Boerhaave, W. Cullen, J.Black, P. Macquer). Sie gewann mit der Zunahme von Kenntnissen über Reaktionen des doppelten Austausches an Bedeutung.
Tatsächlich kann man die doppelte Zerlegung der Art
AB + CD = AC + BD dadurch erklären, dass die Summe der Anziehungskräfte A zu C und B zu D größer ist als die Summe der Anziehungskräfte von A zu B und C zu D. So eine ziemlich komplizierte Schlussfolgerung konnte man nur ziehen, wenn die Affinität als Kraft interpre¬tiert wird; nur Kräfte im Sinne der Mechanik, nicht aber „Anordnungen", „Verhältnisse" und dergleichen ließen sich addieren und subtrahieren. Dieses Vorgehen, benutzt bereits von W. Cullen und J. Black, ist von T. Bergman in seiner Dissertation „Über selektive Anzie¬hungskräfte" entwickelt und fixiert worden [13]. So trafen die Kraftvorstellungen und die durch die Affinitätstabellen dargestellten rein chemischen Gesetzmäßigkeiten schließlich zusammen.
Eine natürliche Fragefolge der Einführung des Kräftebegriffs in die Chemie sollte die Idee vom Gleichgewicht chemischer Kräfte werden: Wenn in der Mechanik Kräfte miteinander im Gleichgewicht stehen können, so muss das gleiche auch für Kräfte in der Chemie gelten. Letztlich ist die Entstehung des Begriffs des „chemischen Gleichgewichts" auch durch die gleiche Logik bestimmt worden. Tatsächlich erwies sich jedoch der Weg keinesfalls als geradlinig: Erstmalig fand der Begriff des Gleichgewichts durch die Erforschung der Wärmeerscheinungen in die Chemie Eingang.
3.2. Wärmestoff in der Chemie
Die außerordentliche Bedeutung der Wärmelehre für die Entwicklung chemischer Vorstellungen wurde im 18. Jahrhundert nicht nur dadurch bestimmt, dass die Entwicklung der Wärme fast das einzige beobachtete Phänomen war, das die Stoff Umwandlung begleitet hat, sondern vor allem dadurch, das Erhitzen die fast einzige Art war, auf die Stoffe zu wirken. Wie konstatierte doch H. Boerhaave (1732): „Die ganze Kunst der Chemie besteht in der Steuerung des Feuers" [14].
Mit der Entstehung der ersten quantitativen Theorie der Wärme, der Wärmestofftheorie, und insbesondere mit der Herausbildung des Begriffs vom „Gleichgewicht der Wärme" wurde es möglich festzustellen – und bald wurde die Idee (W. Kleghorn, J. Black, W. Irvine, A. Lavoisier) auch verwirklicht, – dass den Teilchen des Wärmestoffs das gegenseitige Abstoßen und damit zugleich eine Anziehungskraft zu den Teilchen des übrigen Stoffs immanent ist. Diese Idee, die die ganze Wärmestoffepoche in der Physik und Chemie durchzieht, erlaubte es, die Wärmeerscheinungen in denselben Kraftbegriffen zu be¬schreiben wie die Affinitätserscheinungen.
Schon T. Bergman (1775) diskutierte den Einfluss der Wärme auf das Ergebnis chemischer Umwandlungen als Folge einer Substraktion der Abstoßkräfte der Wärme von einer bestimmten Anziehungskraft, wobei er zum ersten Mal auf die Möglichkeit eines Gleichgewichts dieser beiden Kräfte hinwies [13, p. 15]. Lavoisier und Laplace (1783) haben diesen Gedanken weiterentwickelt, indem sie vorschlugen, das Gleichgewicht zwischen Wärme und Affinität für den Vergleich der Affinitätswerte zu benutzen.
Eine andere konkrete Ausprägung erhielt die Idee des Gleichgewichts unter Einbeziehung des Wärmestoffs in die statische Theorie des Gasaufbaus (W. Irvine, J. Dalton, A. Avogadro); nach dieser Theorie stellt Gas ein unbewegliches System wägbarer Teilchen dar, die von Wärmestoffhüllen umgeben sind, wobei die Abstoßkräfte der Hüllen durch Anziehungskräfte zwischen den Stoffteilchen ausgeglichen werden. Ähnliche Vorstellungen waren sowohl auf die Struktur der Flüssigkeiten und Festkörper ausgedehnt als auch für die Erklärung der Wärmeeffekte bei chemischen Reaktionen benutzt worden. Beginnend mit Lavoisier, gilt als natürliche allgemeine Regel, dass einer größeren Affinität zwischen Körpern auch eine größere Wärmeabgabe bei ihrer Wechselwirkung entspricht, wenn nicht eine Veränderung des Volumens und besonders des Aggregatzustandes hier einhergeht.
Am Ende der Wärmestoffepoche liegen die Forschungen des russischen Chemikers H. Hess.
Aus seinen ersten Beobachtungen fand er, dass „je inniger die sich bildende Verbindung desto größer die entwickelte Wärmemenge ist. Dies lässt uns hoffen, dass die genaue Wärmemessung ein relatives Maß für die Verwandtschaft abgeben und uns zur Entdeckung ihrer Gesetze führen werde“ [15]. Seine weiteren Forschungen führten ihn zum „Gesetz der konstanten Wärmesumme", das den Grundstein für systematische Forschungen auf dem Gebiet der Thermochemie legte.
Der Vorschlag von Hess, die Verwandtschaft durch Reaktionswärme zu messen enthält implizit schon die Idee der Äquivalenz zweier ,,Kräfte"arten - anderenfalls war eine Messung sinnlos gewesen. Indes konnte diese Idee erst nach Anerkennung der Wärme und Affinität als „Kräfte", d. h. als Bewegungsformen, formuliert werden.
3.3. Chemische Statik
Da in der Chemie Ende des 18. Jahrhunderts die Wärmestofftheorie vorherrschte, hatte man die Gleichgewichtserwägungen unter Einbeziehung der Wärme nur als Beschreibung von Gleichgewichten chemischer Kräfte betrachten können. Das war aber durchaus nicht so. In Wirklichkeit war die Anerkennung des Wärmestoffs durch die Chemiker doch mehr platonisch. Eher unbewußt als bewußt hat die Mehrzahl der Forscher Wärme als irgendein abstraktes Wesen angesehen und nicht als einen der üblichen Stoffe. Selbst Bergman, der den Wärmestoff in die Affinitätstabelle einbezog, wies ihm dadurch einen besonderen Platz zu, dass er diese Tabelle in einen niedrigeren und einen höheren Temperaturteil schied. Deshalb stand der Schritt von Gleichgewicht zwischen Affinität und Wärme zum Gleichgewicht zwischen Affinitätskräften noch bevor. Diesen Schritt vollzog Lavoisier, der das Kräftespiel in den Wechselwirkungen der Körper lebhaft spürte. Nach Lavoisier ist zum Beispiel beim Kochen von Metallen mit einer starken Schwefelsäure der Sauerstoff „zwei ungleichen Kräften ausgesetzt: einerseits wird er vom Metall angezogen, das bestrebt ist, sich in Erde, anders ausgedrückt, in Oxyde zu verwandeln, andererseits wird er vom Schwefel festgehalten, und er verteilt sich zwischen diesen beiden solange auf, bis Gleichgewicht eintritt" [16]. Das Neue war hier die Idee der Verteilung eines Stoffes zwischen Reagenzien wegen der Konkurrenz der Affinitäten.
Dennoch beginnt die neue Epoche nicht mit Lavoisier, sondern mit C. L. Berthollet. Erst Berthollet ersetzte das Prinzip der Konstanz der Affinitätsarten durch eine andere Theorie. Seit Mitte des 18. Jahrhunderts wurden in der Chemie Beobachtungen über den Einfluss der Stärke einer Lösung oder der Menge des verwendeten Stoffes auf den Verlauf der „Zersetzung" gesammelt. Fakten für einen solchen Einfluss führten J. Black, C. F. Wenzel, A. Lavoisier, ja auch T. Bergman „selbst" an. Als einen Angriff auf das Prinzip der Konstanz der Affinitätsordnung wurden die genannten Hinweise jedoch noch nicht empfunden. Der Glaube an diese blieb in der Chemie während des ganzen 18. Jahrhunderts erhalten; es ist anzunehmen, dass er nicht so sehr eine Stütze in der Chemie hatte, sondern vielmehr in der diesem Jahrhundert eigenen rationalistischen Weltanschauung und der Überzeugung von der Strenge und Einfachheit der Naturgesetze.
Die Affinitätstabelle – die Verkörperung des genannten Prinzips – blieb als die einzige Form der Vorstellung der Wirkungsgesetze der Affinität übrig. Selbst Lavoisier, der eine ausgereifte Kritik ihrer Unzulänglichkeiten gegeben hatte, beendete seine Erwägungen aus Mangel an einer besseren Form mit einer Affinitätstabelle der verschiedenen Stoffe zum Sauerstoff. Andererseits erscheint es nicht zufällig, daß aus dem Gleichgewichtsschema der Affinitätskräfte, das von Lavoisier vorgeschlagen wurde, nicht ersichtlich ist, wodurch das Gleichgewicht erreicht wird und ob etwas außer der Ergänzung des Wärmestoffs es verletzen kann. Die Idee der Massenwirkung fehlte im Schema von Lavoisier. Folglich galt es, zwei Ideen - das Gleichgewicht chemischer Kräfte und die Massenwirkung - in einer allgemeinen Theorie zu vereinigen, die das Prinzip konstanter Affinitätsreihen ersetzen konnte.
Das wurde von C. L. Berthollet bewerkstelligt. Seine These war, „dass die Wirksamkeit der Stoffe von ihrer Verwandtschaft und von der Menge, die sich im Wirkungsraum befindet, abhängt, dass die letztere ersetzen kann, was der ersteren abgeht“, oder, ausführlicher, „dass in allen Zusammensetzungen und Zersetzungen … sich … derjenige Stoff, auf welchen zwei andere Stoffe mit entgegengesetzten Kräften wirken, zwischen diesen beiden Stoffen teile, und dass das Verhältnis der Teilung nicht bloß von der Stärke der Verwandtschaften, sondern auch von der vorhandenen Menge der wirkenden Stoffe abhängig sei.“ „Man muss die beiden einwirkenden Stoffe als zwei entgegengesetzte Kräfte ansehen“, deren „Wirksamkeit“ „auch von ihrer Quantität“ abhängt. Wegen der Abhängigkeit von der Quantität nimmt bei der Verwandlung eine Kraft ab, die gegenseitige aber nimmt zu. Die Wirkung dauert fort, bis diese beide entgegengesetzten Kräfte zu dem Zustand eines Gleichgewichts gelangt sind" [17],
Die chemische Statik Berthollets stellt den Höhepunkt der „mechanischen" bzw. genauer der „Kraft"-Tradition in der Affinitätslehre und gleichzeitig den Beginn einer neuen Richtung oder, wenn man der Terminologie von I. Lakatos folgt, eines „neuen Programms" dar.
Bis zur Hälfte des 19. Jahrhunderts ist dieses Programm infolge der Vereinigung zweier Ursachen - einer speziellen und einer allgemeinen - unrealisiert geblieben.
Berthollet hat die Begriffe Intensität (Kraft) der Affinität und Stoffmenge, die für die Sättigung erforderlich sind, nicht unterschieden; gerade diese Menge (Quantität) hielt auch er für ein Maß der Affinität. Hieraus erklärt sich die These Berthollets von der unbedingten Variabilität der Struktur der Verbindungen. Seine Niederlage in dem bekannten Streit mit J. L. Proust minderte den Einfluss seiner Lehre. Noch wichtiger war jedoch, dafefür die Chemie der ersten Hälfte des 19. Jahrhunderts die Festigung der atomistischen Auffassung und demzufolge die Erforschung der Stoffzusammensetzung und nicht die der Gesetze der Wechselwirkung von Stoffen grundlegend war. In den Jahren von 1820 bis 1850 ist Berthollets Vermächtnis nicht im Gegensatz „Bergman - Berthollet", sondern im Gegensatz „Proust - Berthollet" oder sogar ,,Da!ton - Berthollet" betrachtet worden.
Die Probleme der Affinität blieben in dieser Zeit im Hintergrund; aber der Ausdruck „Affinitätskraft" gewann einen doppelten Sinn - nicht nur buchstäblich, wie in den mechanischen Systemen Ende des 18. Jahrhunderts, sondern auch metaphorisch, eine gewisse Ursache der Wechselwirkung bezeichnend. Diese zweite Bedeutung verstärkte sich insbesondere in der Periode der Vorbereitung und Entwicklung des Gesetzes von der Erhaltung der Energie.
3.4. Erhaltung der Energie in der Chemie
Diese bedeutsame naturwissenschaftliche Verallgemeinerung hatte vielfältige Wirkungen, darunter auch in der Chemie.
Der unmittelbare Zusammenhang des Gesetzes von der Erhaltung der Energie mit der chemischen Problematik tritt in der Thermochemie zutage. Vor allem das Hess'sche Gesetz erweist sich als spezieller Fall eines allgemeinen Prinzips, wie das bereits Helmholtz hervorgehoben hat. Gleichzeitig gewinnt auch die Vorstellung vom Wärmemaß der Affinität in den Arbeiten von J. Thomsen (1853) [18] eine neue Grundlage; die die Wechselwirkung hervorrufende „chemische Kraft" ist der bei der Reaktion freigesetzte Wärme nach dem Gesetz der Erhaltung der Energie äquivalent. Der gleiche Gedanke liegt der thermochemischen Theorie der elektromotorischen Kräfte der galvanischen Elemente zugrunde (Joule - Helmholtz - W. Thomson, 1841-1851). Später, aber im selben gedanklichen Rahmen, baute M. Berthelot das berühmte System ,,der chemischen Mechanik" auf, das auf die Thermochemie mit dem „Gesetz der maximalen Arbeit“ als dem grundlegenden Prinzip gegründet ist [19]. So wird zum Maß der Affinität nicht die Kraft, sondern die Energie. Weniger klar, jedoch als eine nicht minder wichtige Folgerung des Gesetzes von der Erhaltung der Energie in der Chemie zu betrachten, war die Erneuerung der kinetischen Stoffauffassung. Weiter oben (3.2) sind die mechanischen Konstruktionen, die die Struktur der Gase und Flüssigkeiten beschreiben, erwähnt worden. Mit dem Fall der Wärmestoffhülle werden natürlich diese Konstrukte selbst hinfällig, und die Annahme der Bewegung der Atome (oder Moleküle) bietet sich an. Als erste begriffen das Physiker (Joule, Clausius), und von hieraus begann die Ausarbeitung der kinetischen Stofftheorie; fast unverzüglich wurden jedoch die Vorstellungen von der Bewegung der Teilchen auch in der Chemie ausgenutzt (A. Williamson, 1850; J. Thomsen, 1853). In dieser Hinsicht wirkte die Entdeckung stimulierend, die sozusagen ein neues Stück in der Entwicklungsspirale der Auffassungen vom chemischen Gleichgewicht darstellte, und zwar die Entdeckung der Dissoziation durch Henri Saint-Claire Deville (1857).
3.5. Dissoziation und andere Gleichgewichte in der Chemie von 1850-1870 Jahren
,,Die Dissoziation oder die spontane Zerlegung der Körper unter dem Einfluss von Wärme", spontan „in dem Sinne, dass diese Zersetzung nicht unter Beihülfe einer chemischer Kraft (Verwandtschaft) bewirkt wird" [20], wurde schnell zum Objekt vielfältiger experimenteller Forschungen von hohem Niveau. Zugleich rief wohl keine andere Erscheinung in dieser Zeit soviel theoretische Paradoxa, Diskussionen und Irrtümer hervor. Der Entdecker beschrieb die Dissoziation als Gleichgewicht zwischen Wärme und Affinität. Diese Vorstellung, die auf Bergman und Lavoisier zurückgeht, hat sich auch im 19. Jahrhundert erhalten; man vergleiche beispielsweise J. Liebigs „Chemische Briefe" aus dem Jahre 1844. Das Gleichgewicht wurde statisch vorausgesetzt. Das Temperaturintervall der Dissoziation ist ein Intervall, in dem sich die sich bildenden Moleküle in einem Abstand befinden, der mit dem Radius der Wirkungssphäre der Affinität verglichen wurde. Dieses nach unserer Auffassung etwas sonderbar anmutende Bild spiegelt die widersprüchliche Situation in einer Übergangszeit wider, in der die Wärmestofftheorie schon untergraben, wenn auch noch im Bewußtsein vieler Chemiker lebendig war, die kinetische Theorie hingegen gerade formuliert wurde und noch nicht zum Bestandteil des ständigen Apparats der Chemie gehörte. Daher ist ein kritisches Auftreten gegen die Auffassungen von Deville nicht verwunderlich, und bei den Gegnern sind sowohl Ablehnung des Dissoziationszustandes (Th. Woods) als auch seiner kinetischen Interpretation (H. W. Schröder van der Kolk) festzustellen.
Paradox erscheint auch etwas anderes. Saint-Claire Deville war ebenso wie Berthollet Gegner der atomistisch-molekularen Lehre. Aber gerade die Entdeckung der Dissoziation, die die anomale Dampfdichte erklärte, räumte das letzte große Hindernis zur Bestätigung der atomistisch-molekularen Theorie in der Chemie beiseite und hat gleichfalls für die Konsolidierung der kinetischen Vorstellungen in der Affinitätslehre Gewicht.
Die Vielzahl der Arbeiten zur Dissoziation hatte auch noch eine andere Ursache. Für jedes einzelne Reaktionssystem musste erklärt werden, welchen Gesetzmäßigkeiten es unterliegt, denn eine allgemeine quantitative Theorie des chemischen Gleichgewichts fehlte noch. Die 60er Jahre brachten in dieser Hinsicht einen wichtigen Umschwung; 1862 wurde in der klassischen Arbeit von M. Berthelot und L. Pean de Saint-Gilles eine quantitative Beschreibung der Geschwindigkeit und des Gleichgewichts der Bildung und Zersetzung der Äther gegeben [21]. Sich auf diese Arbeit stützend, begannen C. M. Guldberg und P. Waage ihre bedeutsamen „Forschungen zur chemischen Verwandtschaft" (1864-1867) und stellten, ausgehend von den Kräftebeziehungen, die einfachste Form des Massenwirkungsgesetzes auf. Die Theorie von Guldberg und Waage bezog sich auf die Gleichgewichte des doppelten Austausches und bildete nicht die Dissoziation ab; andererseits äußert sich Saint-Claire Deville ziemlich unhöfflich über „die dunklen Ideen" Berthollets bezüglich der Massenwirkung [22].
Es gab aber auch eine dritte Richtung in der Erforschung des Gleichgewichts in der Chemie: Die Arbeiten zur Stofflöslichkeit, zum Dampfdruck und zu Siede- bzw. Gefrierpunkten von Lösungen bestätigten allmählich die Vorstellung vom Löslichkeitsgieichgewicht und führten zur Entdeckung der einfachen Gesetzmäßigkeiten dieses Gleichgewichts.
Diese ursprünglich Voneinander getrennten drei Richtungen begann man seit der zweiten Hälfte der 60er Jahre zu einer einheitlichen Gleichgewichtsauffassung zusammenzuführen. Zur gemeinsamen Plattform wurde dabei die molekular-kinetische Theorie. 1867 schuf L. Pfaundler ein anschauliches kinetisches Bild von den Gleichgewichten der Dissoziation und des doppelten Austausches. Bald folgten weitere Präzisierungen und Anwendungen (A. Naumann, A. Horstmann, L. Dossios, später Guldberg und Waage). Um 1880 formierte sich die Gleichgewichtslehre zu einem Bereich der theoretischen Chemie.
3.6. Zwei Affinitätslehre
Um 1880 wurden zwei Systeme über die Wirkungsgesetze und das Maß der chemischen Affinität vertreten: Das auf der Vorstellung vom reversiblen chemischen Gleichgewicht beruhende und das thermochemische.
Das erstere war ausschließlich für die Erforschung des Gleichgewichts als solches aufgebaut worden, und, obwohl es sich auf die Vorstellung vom beweglichen Gleichgewicht stützte, benutzte es nicht.das Maß der Bewegung, die Energie. So war es nur möglich, Gleichgewicht und Affinitätsgröße einzig vom Standpunkt der „Massenwirkung" quantitativ zu bestimmen; durch die Gleichgewichtskonzentrationen der reagierenden Stoffe wurde auch die Größe ihrer wechselseitigen Affinität ausgedrückt.
Das zweite System war von dieser Begrenztheit der Gleichgewichtsauffassung frei: Es berücksichtigte die energetische Seite der Reaktion, was ihm auch viele Phänomene zu erklären ermöglichte und seine selbständige Existenz und Entwicklung bedingte. Indem das System ein Maß der Bewegung (die Wärmereaktion) benutzte, ließ es die Bewegung selbst aus den Augen und war nicht imstande, das bewegliche Gleichgewicht überzeugend zu erklären. Das Prinzip der maximalen Arbeit. ist, wie Berthelot selbst betonte [19, t. II, p.417], ein statisches Prinzip und setzt an und für sich die Existenz beweglicher Gleichgewichte nicht voraus.
Ursprünglich koexistierten beide Systeme in der Chemie friedlich nebeneinander und kamen, ohne übereinzustimmen, auf den Seiten ein und desselben Buches vor. Besonders eindrucksvoll trat dies in den Werken Berthelots zutage, als er 1877 in ein und derselben Ausgabe der ,,Comptes Rendus" über die Bestätigung des Prinzips der maximalen Arbeit und über die der Ätherbildungstheorie berichtete.
Indes wurde allmählich klar, dass es sich um zwei einander widersprechende und unvollständige theoretische Systeme über dasselbe Objekt handelt. Nach W. Ostwalds Worten : „Wie in der Sage die längst gefallenen Krieger nächtlicher Weile wieder zum Leben erwachen, um den unentschieden gebliebenen Kampf fortzusetzen, so sehen wir noch in unseren Tagen jene beiden Theorien nach langer Erstarrung wieder gegen einander kämpfen. Freilich nicht mehr mit den alten Waffen: Berthollets Theorie hat den Panzer mathematischer Fassung angetan, während Bergmans Theorie durch das schwere Geschütz der Thermochemie verteidigt werden soll" [23]. Die weitere Entwicklung der Affinitätslehre wurde ohne die Vereinigung der beiden Theorien auf einer gemeinsamen Basis unmöglich. Zu einer solchen Grundlage hätte die molekularkinetische Anschauung werden können. Indes war sie noch zu unvollkommen und für die Chemiker ein System qualitativer Modellvorstellungen geblieben. Ebenso hatte sich vor einem Jahrhundert in der Wärmelehre eine zu detaillierte Theorie als ungünstig für ihre quantitative Ausbildung erwiesen, und sie räumte der phänomenologischen Theorie das Feld.
Die Thermodynamik, die weitere Anstrengungen erfordert, und die Affinitätslehre, die eine einheitliche theoretische Basis braucht, bilden die zwei nunmehr sich treffenden Ströme, deren Verbindung unvermeidlich wird.
4. Entstehung der chemischen Thermodynamik
4.1. Anfänge
Die ersten erfolgreichen ,,Durchbrüche" der Thermodynamik in der Chemie gehören zu den Fällen, die mit Erscheinungen der Veränderung des Aggregatzustandes einhergehen - zu den heterogenen Gleichgewichten in Lösungen (R. Kirchhoff, 1858; J. Loschmidt, 1869; C. M. Guldberg, 1870) und zur Dissoziation von Festkörpern (A. Horstmann, 1869-1870; C. M. Guldberg, 1872). Diese Anwendungen der Thermodynamik in der Chemie waren episodenhaft, isoliert voneinander und stützten sich auf keine allgemeine Methode.
Erst 1873 gelang es dem Dozenten der Chemie in Heidelberg A. Horstmann [24] einen allgemeinen Weg der thermodynamischen Analysen des chemischen Gleichgewichts zu finden. Ausgehend von dem Prinzip der Vermehrung der Entropie, formulierte er die These, dass die Bedingung für das Gleichgewicht isolierter Systeme ein Maximalwert ihrer Entropie ist. So wurde die neue thermodynamische Methode geboren, die sich auf das Gleichgewichtskriterium stützte. Dieses Ereignis vollzog sich aber fast unbemerkt, und selbst konkrete Ergebnisse, die von Horstmann gewonnen wurden – von ihm war auch eine experimentell bestätigte Theorie der Dissoziation entwickelt worden – erregten nicht die Aufmerksamkeit seiner Kollegen. Die Krise in der chemischen Mechanik war noch nicht herangereift, und die Anwendung der abstrakten physikalischen Theorie schien nicht notwendig, noch mehr, sie rief seitens F. Mohrs Angriffe hervor [25].
Zeitgemäßer erwies sich die Arbeit von H. Helmholtz „Die Thermodynamik chemischer Vorgänge" (1882) [26], die sofort allgemeine Anerkennung errang. Gewiß spielte hierbei der große wissenschaftliche Ruf des Autors eine Rolle. Helmholtz löste nicht nur die brennende Frage der Elektrochemie über den Zusammenhang zwischen der elektromotorischen Kraft des galvanischen Elements und der Wärme des sich in ihm vollziehenden chemischen Prozesses, sondern er wies auch das Vorgehen bei der Lösung des allgemeinen Problems vom Maß der chemischen Affinität nach. Indem Helmholtz den Wert der Energie eines chemischen (und jedes anderen) Prozesses in freie und gebundene Energie einteilte, bewies er, dass das Reaktionsergebnis gerade durch den Wert der Veränderung der freien Energie bestimmt wird. Gleichzeitig stellte er bemerkenswerte Eigenschaften durch die von ihm entdeckte neue thermodynamische Größe fest: Diese Größe ist eine charakteristische Funktion und drückt außerdem die größte Arbeit aus, die im Ergebnis eines Prozesses erzeugt werden kann. Ihre letztgenannte Eigenschaft gibt die Kriterien für das Systemgleichgewicht an: Bei Gleichgewicht (unter isothermischen Bedingungen) muss die freie Energie ein Maximum sein.
4.2. Ausgestaltung einer neuen Disziplin
Die Formierung der chemischen Thermodynamik vollendete J. H. van't Hoff (1884-1887) [27]. Er entwickelte die Methode von den reversiblen Prozessen mit Hilfe des Begriffs der halbdurchlässigen Wände. Das ermöglichte es, die Funktion einzelner Stoffe im chemischen Prozeß zu bestimmen. Durch seine Methode ermittelte van't Hoff wichtige Beziehungen der chemischen Thermodynamik, darunter die Gleichung für das Massenwirkungsgesetz, die Reaktionsisochore, die kryoskopische Formel. Auf der Grundlage der chemischen Thermodynamik löste van't Hoff die Widersprüche zwischen thermochemischem System und Gleichgewichtslehre. Zugleich war die Umgestaltung der Theorie der elektromotorischen Kräfte, die von Helmholtz begonnen wurde, abgeschlossen worden. Die Arbeiten van't Hoffs hatten die Stellung der Thermodynamik in der Chemie verändert, und die vorausgegangenen Arbeiten Kirchhoffs, Horstmanns, Helmholtz' und anderer sind im Rahmen einer neuen Disziplin miteinander vereinigt worden.
Der Fragenkreis, der zu ihrem Bereich gehörte, war ursprünglich ziemlich eng. Er umfasste das Gleichgewicht chemischer Reaktionen in Gasen und verdünnten Lösungen, einfachste heterogene Gleichgewichte (mit reinem Stoff als eine der Phasen), zum Teil elektrochemische Reaktionen in galvanischen Elementen. Kompliziertere Fälle wie zum Beispiel der allgemeine Fall des heterogenen Gleichgewichts in Lösungen harrten noch der Ausarbeitung. Die effektivste und einfachste in mathematischer Hinsicht war die Methode van't Hoffs. Die analytischen Methoden brauchten Verbesserungen; das erforderte, eine Ausdrucksform für die Rolle einzelner Stoffe zu finden (Versuche in dieser Richtung hatten Horstmann und Helmholtz vorgenommen), die Verbindung zwischen dem Gleichgewichtskriterium Horstmanns und Helmholtz' herzustellen und die Gleichgewichtskriterien für die verschiedenen Bedingungen der Abgeschlossenheit des Systems aufzudecken. Ungeachtet dieser Unzulänglichkeiten war die junge Wissensehaftsdisziplin voll lebensfähig, und sie begann sich rasch zu entwickeln. So hat M. Planck, ausgehend vom Prinzip der Vermehrung der Entropie, eine allgemeine Ableitung der Gesetze vom Gleichgewicht in Gasen und verdünnten Lösungen gegeben (1887). W. Nernst leitete mit der van't Hoffschen Methode die Gleichung der Reaktionsisotherme ab (1893). A. Le Chatelier nahm unter Ausnutzung der Methode totaler Differentiale die Ausarbeitung der Berechnungsarten der chemischen Gleichgewichte der Reaktionen (1888) in Angriff. Wesentliche Resultate sind auch auf dem Gebiet der Thermodynamik der Lösungen und der Phasengleichgewichte in Lösungen gewonnen worden (I. F. Schröder, 1890; M. Margules, 1895 und andere). Es war nicht daran zu zweifeln, dass in der weiteren Entwicklung alle oben genannten theoretischen Probleme gelöst würden, sowohl im Sinne der Erweiterung des Gebietes der Anwendung der Theorie als auch im Sinne der Vervollkommnung ihrer Methoden. Diese Probleme waren jedoch bereits durch J. W. Gibbs entschieden worden.
Das große Werk Gibbs' (1875-1878) enthielt zwei grundlegende Aspekte. Erstens schuf er eine mächtige Methode, die in der Ausnutzung thermodynamischer Potentiale einerseits als charakteristische Funktionen, andererseits als Funktionen unmittelbar ausdrückbarer Gleichgewichtsbedingungen bestand. Die Konkretisierung dieser Methode, angewandt auf die Chemie, wird durch die Einführung der chemischen Potentiale und des Begriffs Komponente und Phase erreicht. Zweitens hat Gibbs, basierend auf seiner Methode, eine Theorie aller grundlegenden Gleichgewichtsfälle in der Chemie – der chemischen und Phasengleichgewichte, der Gleichgewichte unter Einbeziehung elektrischer und kapillarer Kräfte, stabiler und instabiler
Gleichgewichte – gegeben.
Die thermodynamische Lehre von Gibbs entstand als logische Konsequenz der allgemeinen Thermodynamik, sie stellte ein System dar, das im Rahmen der theoretischen Physik lag. Ihrem theoretischen Inhalt nach war Gibbssche Lehre jener Abschluss, zu dem die in Europa sich herausbildende chemische Thermodynamik kommen musste; wegen ihres Zusammenhanges mit experimentellen Forschungen war Gibbssche Thermodynamik jedoch weit davon entfernt. Es musste ein „Abstieg" von den eroberten theoretischen Höhen erfolgen, um dem experimentellen Material entgegenzukommen.
Dieser ,,Abstieg" bereitete jedoch ernsthafte Schwierigkeiten. Bekanntlich hat die Lehre von Gibbs während annähernd eines Jahrzehnts keine Entwicklung genommen. Die Auffassung war lange verbreitet, dass sie in Europa einfach nicht bekannt geworden sei. Das ist aber nicht der Fall gewesen. Eine Anzahl Publikationen Ende der 70er und Anfang der 80er Jahre legen Zeugnis davon ab, dass man bereits in diesen Jahren in Europa ziemlich gut über die Arbeiten Gibbs' informiert war. Wir verweisen auf die Vorträge von J. C. Maxwell „Über das Gleichgewicht heterogener Stoffe" (1876) [28] und eine Reihe von Referaten und nachgedruckten Artikeln von Gibbs in europäischen Zeitschriften [29]. Tatsache ist, dass eine Information über die Gibbs'schen Arbeiten noch nicht ihr Verständnis bedeutete. Dies war nur einzelnen wie Maxwell oder van der Waals vorbehalten.
Erst um die Mitte der 80er Jahre reiften dank der Arbeiten von Maxwell, Horstmann und Helmholtz Vorstellungen heran, die eine Aufnahme der Ideen von Gibbs förderten. Seit der zweiten Hälfte der 80er Jahre erhielt die Lehre von Gibbs eine weitere Entwicklung in den Arbeiten von Duhern und besonders in den Forschungen der holländischen Schule der Physikochemiker. Daher schließt um die Mitte der 80er Jahre sowohl die „verborgene Periode" in der Gibbs'schen Ideenaufnahme als auch die Formierung der chemischen Thermodynamik in Europa ab. Es beginnt eine schnelle Entwicklung beider Zweige der chemischen Thermodynamik.
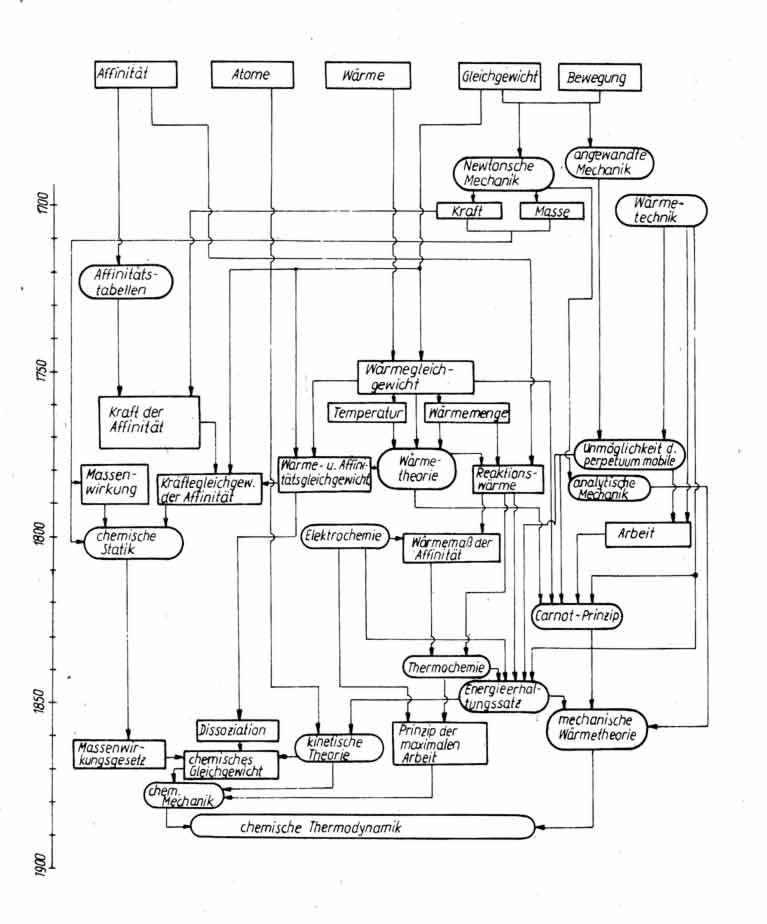
5. Fazit
Das Schema, das die Genese der chemischen Thermodynamik veranschaulichen soll, fasst das bisher Gesagte zusammen.
Als allgemeine Schlussfolgerung kann abgeleitet werden, dass die Schaffung neuer Theorien und selbst neuer Disziplinen in verschiedener Hinsicht ebenso die Ausarbeitung neuer Begriffe wie die Übertragung schon existierender aus einer Wissenschaft in eine andere in sich einschließt.
Anmerkungen
1. A. Einstein, L. Infeld: Die Evolution der Physik. Wien, 1950, S. 52.
2. J. Black: Lectures on the Elements of Chemistry. -Edinbourgh 1803, vol. I, p. 76-77.
3. J. Fourier: Théorie analytique de chaleur. - Paris 1822. - p. II - III.
4. S. Carnot.: Réflexions sur la puissance motrice du feu et sur les machines propres a développer cette puissance (1824). – Édition Critique …, augmentée de documents d’archives et de divers manuscrits de Carnot par Robert Fox. Paris, 1978. (Das Zitat wird nach der Übersetzung ins Deutsch von Wilhelm Ostwald gegeben, Klassiker der exakten Wissenschaften Nr. 37, S. 23).
5. J. Forrester: Chemistry and the conservation energy: the work of James Prescott Joule. In: Studies in History and Philosophy of Science, 1975, vol. 6, p. 273-313 (p. 274).
6. E. Mach: Die Principien der Wärmelehre historisch-kritisch entwickelt. Leipzig, 1896, S. 269.
7. E. Mendoza: The writing of the «Réflexions» and their reception, In: Sadi Carnot et l'essor de la thermodynamique. - Paris 1976, p. 169-181 (p.169-171).
8. W.Thomson: An Account of Carnot’s theory of the motive power of heat (1849), Mathematical and physical papers. -Vol. I. –Cambridge 1882, p. 116-119.
9. R. Clausius: Über die bewegende Kraft der Wärme und die Gesetze, wel¬che sich daraus für die Wärmelehre selbst ableiten lassen. In: Pogg. Ann. 1850, 79, 368-397, 500-524 (S. 372).
10. C. L. Berthollet: Essai de statique chimique. - Paris 1803. T. l, p. 6. (Zitiert nach der Übersetzung ins Deutsch : Versuch einer chemischen Statik, Berlin, 1811 Bd. 1, S. 8).
11. N. Lemery. Cours de chimie. 5me ed., Paris, 1683, p. 338.
12. Arnold Thackray: Atoms and powers. An essay on Newtonian matter theory and the development of chemistry. Harvard Univ. Press, 1970.
13. T. A. Bergman: Dissertation on Elective Attractions. Translated from the Latin Language. - London 1785.
14. Dr. Boerhaave’s Elements of Chymistry, faithfully abridg’d from the late Genuine Edition. London, 1732, p. 102.
15. H. Hess: Notiz über Wärmeentwicklung in festen Verhältnissen. Pogg. Ann., 1839, 47, 210-212; auch in: Die Grundlagen der reinen Chemie. - 5. Aufl. - St. Petersburg, 1840. - S. 19-20. (S. auch Ostwalds Klassiker No 9. - Leipzig 1890).
16. A. L. Lavoisier: Note sur les Tables d'affinites. - In: Essai sur le phlogistique et sur la constitution des acides, traduit de I' anglois de M. Kirwan. -Paris 1788. - p. 46-57.
17. C. L. Berthollet: Recherches sur les lois de l’affinité, Paris, an IX [1801]. Zitiert nach der deutschen Übersetzung von E. G. Fischer: Über die Gesetze der Verwandtschaft in der Chemie, Berlin, 1802, S. 181, 7, 22-24 (s. auch den Neudruck: Ostwalds Klassiker, Nr. 74, Leipzig, 1896, S. 70, 5, 9-10)
18. J. Thomsen: Die Grundzüge eines thermochemischen Systems. - In: Pogg. Ann. 1853, 88, 349-362; 90, 261-288; 1854, 91, 83-104; 92, 34-57.
19. M. Berthelot: Essai de Mécanique chimique fondée sur la Thermochimie. T. l-ll. Paris, 1879.
20. H. Saint-Claire Deville: De la dissociation ou décomposition spontanée des corps sous l'influence de la chaleur. -In: Comptes rend. 1857, 45, 857-861 (Das Zitat wird nach der deutschen Übersetzung gegeben: Liebigs Ann., 1858, 105, 383);
21. M. Berthelot; L. Pean de Saint-Gilles: Recherches sur les affinités. De la formation et de la decomposition des ethers. - In: Ann. chirm. phys. 1862, 65, 385-422; 66, 5-110; 1863, 68, 225-359 (Ostwalds Klassiker No 173. - Leipzig 1910).
22. H. Saint-Claire Deville. Leçons sur la dissociation, in : Leçons de chimie, professées á la société chimique de Paris en 1864 et 1865. - Paris 1866. - p. 255-378 (p. 339).
23. W. Ostwald: Die Energie und ihre Wandlungen. - Leipzig 1888, S. 21-22.
24. A. Horstmann: Theorie des Dissociation. - In: Lieb. Ann. 1873, 170, 192-210 (Ostwalds Klassiker No 137. - Leipzig 1903).
25. F. Mohr: Theorie der Dissociation oder Thermolyse. - In: Liebigs Ann. 1874, 171, 361-379.
26. H. Helmholtz: Die Thermodynamik chemischer Vorgänge. - In: Sitzungsber. Akad. Wiss. Berlin, 1882, 2. Febr., S. 22-39 (Ostwalds Klassiker No 124, Leipzig, 1902).
27. J. H. van't Hoff: Etudes de dynamique chimique. - Amsterdam 1884; L'équilibre chimique dans les systèmes gazeux ou dissous à l'état dilué. - In: Arch. Neerl. 1886, 20, 239-302; Die Rolle des osmotischen Druckes in der Analogie zwischen Lösungen und Gasen. - In: Z. physik. Chem. 1887, 1, 481-508.
28. J. C. Maxwell: On the Equilibrium of Heterogeneous Substances. - In: South Kensington Museum Conferences held in connection with the Special loan collection of scientific apparatus. Physics and mechanics. - London 1876. - p. 145-150 (reprinted in Philos. Mag., 1908, v. 16, p. 818-824).
29. J. W. Gibbs: On the Equilibrium of Heterogeneous Substances. - In: Repertorium der Mathematik (Leipzig) 1879, 2, 300-320; Beibl. zu Wied. Ann.1880, 4, 864-871.