УДК 669.243.001.891.3
А. Я. КИПНИС
ПРОБЛЕМЫ ОБРАЗОВАНИЯ НОВОЙ ФАЗЫ В ХИМИЧЕСКИХ РЕАКЦИЯХ
МЕТАЛЛУРГИИ НИКЕЛЯ
В производстве никеля имеется ряд технологических процессов, протекание и результаты которых определяются образованием новой твердой фазы (или фаз) в результате химических реакций. Таково, например, выделение металлического никеля путем автоклавного восстановления водородом из растворов и пульп или путем термического разложения карбонила никеля. Другим характерным примером может служить гидролитическое осаждение железа в ряде переделов. Подобные процессы образования твердой фазы при химических реакциях называют «химическим осаждением», «химической кристаллизацией». Специфика химического осаждения определяется взаимодействием химической реакции и зарождения и роста твердой фазы; общей теории этого сложного явления не существует, хотя отдельным конкретным процессам посвящена обширная литература, в частности, монографии [1—9] и сборник [10].
В настоящей статье рассматриваются некоторые аспекты теории химического осаждения, выявленные при исследовании процессов получения никеля карбонильным и автоклавным способами, а также процессов гидролитического осаждения железа; эти процессы можно рассматривать как типовые модели множества других случаев химического осаждения.
Механизмы зарождения новой фазы
Классическая теория зарождения новой фазы [11, 12] опирается на представление о метастабильном критическом зародыше — агрегате, или кластере* из g мономерных частиц, свободная энергия образования которого максимальна. [* Несмотря на некоторую неопределенность в использовании термина «кластер» в различных областях физики и химии, можно принять следующее определение: кластер это выделенная некоторым образом группа связанных между собой одинаковых или сходных частиц, число членов которой ограничено и, вообще говоря, может быть переменным [13—17].] Агрегация мономерных частиц описывается цепочкой равновесий вида
Ag + A = Ag+1 (g = 1, 2, 3, ...) (1)
и для всех докритических кластеров сопровождается ростом свободной энергии образования. Таким образом, торможение зарождения новой фазы определяется термодинамическим барьером.
Эти же предпосылки часто переносят на химическое осаждение, что имеет основание, по крайней мере формальное, в случаях обратимых реакций. В описываемых исследованиях выявлен другой механизм химического осаждения, по-видимому более распространенный: начало процесса — реакция, дающая моноядерные комплексы, способные к образованию кластерных соединений возрастающей степени агрегации; агрегация с самого начала протекает со снижением свободной энергии; критические зародыши не возникают; зарождение новой фазы тормозится кинетическими факторами при агрегации, а не упомянутым выше термодинамическим барьером.
Этот механизм зарождения новой фазы обусловлен тем, что агрегация моноядерных комплексов в олигоядерные, затем — в полиядерные и, наконец, в частицы твердой фазы происходит со снижением свободной энергии. Такая агрегация может быть уподоблена процессам полимеризации или — чаще — поликонденсации.
Объектом, на котором был выявлен описанный механизм, послужила химическая кристаллизация никеля при термическом разложении карбонила никеля. Проведенные исследования включали в себя:
—масс-спектрометрическое изучение начальных стадий процесса [18];
—определение методами сравнительного расчета термодинамических свойств кластеров и малых частиц металлического никеля [19], а также вероятных промежуточных продуктов — моно-, би- и многоядерных субкарбонилов никеля и малых частиц никеля, стабилизированных окисью углерода [20, 21];
— изучение кинетики термического разложения карбонила никеля с использованием специально разработанных проточных реакторов [22, 23] и применением методов аэрозольной техники для характеристики образующихся частиц никеля [23];
—электронномикроскопическое изучение частиц никелевых порошков [23, 24];
—математическое моделирование отдельных стадий и всего процесса [25, 26].
В результате установлено, в частности, что первой стадией процесса является обратимая диссоциация до трикарбонила:
Ni(CO)4 = Ni(CO)3 + CO (2)
а последующие его стадии могут быть описаны обобщенной схемой:
Nig(CO)x + Nij(CO)y → Nig+j(CO)x+y-z + zCO(3)
Агрегация субкарбонильных осколков по этой схеме является активированной, с энергией активации от 9 ккал/моль при g = j = 1 до 0 при g + j≥ 12.
Ниже приведены вычисленные по данным [19—21] значения стандартной свободной энергии образования из карбонила никеля некоторых субкарбонильных осколков с числом атомов никеля от 1 до 6 (кал/моль для 450 К):
|
Ni(CO)3 |
Ni2(CO)6 |
Ni3(CO)9 |
Ni4(CO)11 |
Ni5(CO)14 |
Ni6(CO)16 |
|
+1800 |
+400 |
- 3800 |
- 6000 |
- 9000 |
- 11800 |
Как видно из этих чисел, для выбранных составов многоядерных субкарбонилов агрегация происходит со снижением свободной энергии, т. е. термодинамический барьер, предполагаемый классическим механизмом зарождения, в этом случае отсутствует.
Неклассический механизм зарождения новой фазы — в отсутствие термодинамического барьера, через кинетически затрудненную агрегацию мономеров и кластеров — установлен для ряда случаев физической конденсации однокомпонентного пара [27], однако наиболее характерен он, по-видимому, именно для процессов химического осаждения, где взаимодействие со средой частиц-предшественников новой фазы неизбежно. В частности, высокотемпературный термолиз пентакарбонила железа протекает через осколки FeCO [28]. Можно предположить, что схемы аналогичные (3) справедливы и для термического разложения других металлорганических соединений, однако до настоящего времени такая трактовка процессов не учитывается [7].
Аналогичный механизм зарождения новой твердой фазы — через химическую агрегацию мономерных комплексов — характерен для глубокого гидролиза железа(III) , однако здесь выявляется еще одна сторона процессов химического осаждения, требующая специального обсуждения.
Множественность путей химического осаждения.
Легко видеть, что при химическом осаждении состав растущих кластеров описывается минимум двумя числами: например, g и x в схеме (3). Иначе говоря, если при физической кристаллизации траектория процесса в пространстве состояний системы является одномерной, то химическая кристаллизация — процесс «многоканальный».
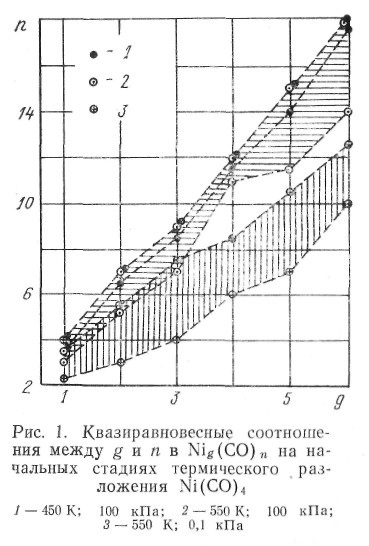
Однако для случаев, когда существует лишь один продукт реакции — например, при термическом разложении карбонила никеля, возможно описание процесса одномерной траекторией в пространстве «состав кластера — свободная энергия образования кластера». Допустимость такой аппроксимации проверена именно для этого случая. С этой целью были выполнены машинные расчеты мгновенных равновесий между частицами Nig(CO)n (g = 0, l,..., 6; n = 0, 1, ..., 18), отвечающих этапам агрегации до g = 2, 3, 4, 5 и 6 *[* Возникновение мгновенных равновесий, или — точнее — промежуточных квазиравновесных состояний, возможно для быстрых стадий, предшествующих медленным.]
Расчеты, в которых учитывалось более 70 веществ, показали, что:
— при равновесии во всех случаях подавляющая часть субкарбонильных кластеров имеет наибольшую степень агрегации, возможную на данном этапе развития процесса (ср. со сказанным выше об агрегации с непрерывным снижением свободной энергии);
— отношение п / g практически постоянно при заданной температуре и начальном давлении (рис. 1), т. е. состав основной массы кластеров можно характеризовать одним числом.
Действительно, результаты математического моделирования этого процесса, основанные на одномерной аппроксимации, согласуются с экспериментальными данными, приведенными в настоящей работе далее.
Существенно иная картина возникает при одновременном образовании в процессе химического осаждения двух или нескольких фаз, как это имеет место при гидролизе железа(III).
Как известно [29], первичные реакции гидролиза дают два различных моноядерных гидроксокомплекса:
[Fe (H2O)5OH]2+ и [Fe(H2O)4(OH)2]+ ,
каждый из которых способен конденсироваться в полигидроксо-комплексы с убылью свободной энергии. Полигидроксокомплексы представляют собой те или иные комбинации железокислородных октаэдров
Главными исходными блоками для построения конечных структур следует считать три типа олигоядерных комплексов:
— однорядные цепи октаэдров с тремя и более звеньями
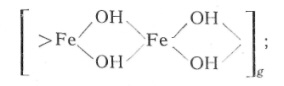
— «компактные тримеры» [Fe3O(OH)3(H2O)]9 4+, в которых три октаэдра имеют общий мостиковый атом кислорода;
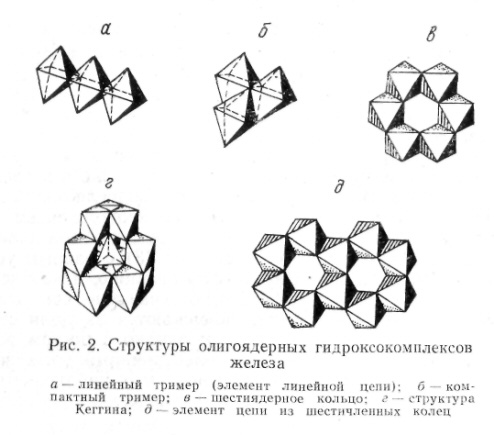
— циклические шестиядерные комплексы (рис. 2, а, б, в).
Шестичленные кольца могут в дальнейшем образовывать «сдвоенные цепи» (рис. 2,(д). Наконец, известны двенадцатиядерные тетраэдрические формы типа так называемой структуры Кеггина (рис. 2, г); они могут образовываться, например, из четырех «компактных тримеров», объединяемых вокруг центрального тетраэдра (например, иона SO42+ или Fe 3+ ).
Исследование кинетики глубокого гидролиза в сочетании с ультрафильтрационным разделением полигидроксокомплексов и мессбауэровской спектроскопией различных фракций замороженных растворов и осадков и анализ совокупности существующих данных позволили предложить [30] схему (рис. 3), наглядно демонстрирующую множественность путей образования новых фаз при гидролизе железа *. [* Схема доложена на двух всесоюзных совещаниях в 1980 и 1981 гг. [31, 32];позднее независимо установлена и подтверждена швейцарскими исследователями [33].]
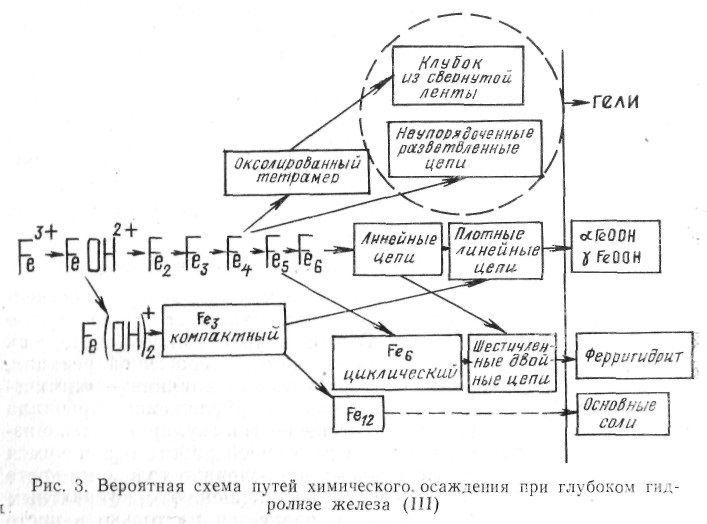
Следует подчеркнуть, что вследствие весьма активных взаимодействий растущих комплексов со средой наряду с компактными структурами, ведущими к образованию кристаллических фаз, возникают полигидроксокомплексы — возможно, свернутые в клубки, ленты и цепи [33], — способные к длительному существованию в растворе в виде коллоидных частиц. В частности, линейный тетрамер выделен в чистом виде [34], а продукт его роста, с образованием плоской ленты шириной в 4 и длиной около 250 железо-кислородных октаэдров, найден в виде устойчивых коллоидных частиц [35].
Таким образом, можно предполагать, что множественность путей химического осаждения определяется существованием нескольких соизмеримых по устойчивости фаз, являющихся конечными продуктами химических реакций.
Роль коагуляции в процессах химического осаждения
Тот факт, что при зарождении новой фазы в объеме последующие стадии роста протекают по коастгуляционному механизму, первоначально установлен при изучении образования конденсационных аэрозолей [27]; известна также роль «агрегации» (т. е. коагуляции) малых кристаллов в процессах массовой кристаллизации из растворов [36]. Поэтому представляется неизбежным признание вклада коагуляции в образование новых фаз также и в процессах химического осаждения. Действительно, коагуляция растущих частиц новой фазы является естественным продолжением термически активируемой агрегации, и граница между этими явлениями размыта: соединение частиц по схеме вида (3) с равным успехом можно рассматривать и как химическую реакцию, и как коагуляцию. Начальные стадии коагуляции, отвечающие счетным концентрациям золей 10'5—1020 см-3, завершаются за доли секунды и не поддаются прямому наблюдению; однако с ростом размера частиц становится возможным их электронномикроскопическое изучение, непосредственно показывающее, что наблюдаемые частицы представляют собой агрегаты более мелких частиц, т. е. продукты коагуляции.
Рост частиц аэрозоля никеля, получающегося при разложении карбонила никеля, обнаруживает некоторые специфические особенности. Первоначально он протекает как обычная газокинетическая коагуляция.* [* Усложнения, связанные с гетерогенной химической реакцией на частицах, рассматриваются в следующем разделе.] Это соответствует предположению о сферичности частиц и полном их слиянии (коалесценции) при столкновении или, по крайней мере, за время, предшествующее следующему столкновению.
По достижении частицами никеля размеров, при которых возникает спонтанная намагниченность, характер коагуляции изменяется: она становится направленной вследствие магнитного взаимодействия между частицами — ферромагнитными доменами.. В результате наблюдается лавинообразное ускорение коагуляции; при этом коалесценция между соударениями не успевает завершиться, и возникают нитевидные агрегаты, состоящие из малых: сферических частиц никеля.
Критический размер частиц никеля, начиная с которого коагуляция становится направленной, растет с ростом температуры от — 130 А (13нм) при 150°С до 220 А (22 нм) при 330°С [23].
При получении никеля автоклавным восстановлением из растворов и пульп водородом механизм коагуляции отличается от описанного выше; в этом случае соударения частиц определяются гидродинамикой перемешивания; коагуляция является вынужденной, но протекает, по-видимому, медленнее, чем газокинетическая, вследствие громадной разницы в вязкости жидкости и газа. Однако сам факт роста частиц никелевого порошка путем коагуляции и последующей коалесценции твердо установлен даже для поздних стадий процесса, отвечающих размерам частиц в десятки микрон [37].
Помимо собственно коагуляции (агрегации) частиц растущей фазы, следует рассматривать и коалесценцию (спекание) столкнувшихся частиц. Характерное время спекания, т. е. время полного зарастания шейки между сферическими частицами диаметра d, в большой степени зависит от диаметра частиц; при спекании по механизму поверхностной диффузии оно пропорционально d4, а при спекании путем переноса через газ или раствор — пропорционально d3. Поэтому, по мере увеличения размера частиц, с некоторого момента коалесценция начинает «отставать» от коагуляции, что проявляется в структуре частиц новой фазы.
При гидролитическом осаждении железа эта стадия процесса представляется более сложной. Вдоль разных путей гидролиза, представленных на рис. 3, характер и роль коагуляции различны: коагуляция коллоидных частиц полигидроксокомплексов, ведущая к образованию гелей и/или рентгеноаморфных гидроокислов железа, является вторичным процессом, который может последовать за далеко продвинувшейся агрегацией, но не ведет к образованию новых макромолекул; с другой стороны, рост кристаллических фаз протекает, по-видимому, как «ориентированное наращивание» [38], или активированная агрегация моно- и олигоядерных гидроксокомплексов с полигидроксокомплексами — предшественниками кристаллических фаз — см. рис. 3, а также [33].
Скорость гетерогенной реакции на малых частицах
При возникновении частиц новой фазы, обладающих собственной поверхностью, их дальнейший рост включает гетерогенную реакцию на этой поверхности. В этом случае важно понять, как размер малых частиц влияет на скорость гетерогенной реакции, идущей на их поверхности. Сам факт такого влияния — «химический размерный эффект» — установлен для разложения карбонила никеля. Было бы желательно выяснение молекулярных механизмов подобных эффектов, однако в настоящей работе ограничимся феноменологическим рассмотрением; оно основано только на учете избыточной энергии малых частиц по сравнению с компактным металлом, хотя влияние размера проявляется не только в чисто энергетических, но и в электронных, оптических, структурных характеристиках таких частиц [15, 16].
Термодинамические характеристики малых частиц никеля возьмем по выполненной ранее работе [19]:

Рассмотрим влияние избыточной энергии на течение обратимой эндотермической реакции — например, разложения карбонила никеля или восстановления ионов никеля из раствора водородом; первая поглощает 34, вторая — 12,8 ккал/моль.
Пусть реакция на компактном металле характеризуется скоростями в прямом и обратном направлении 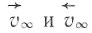 и соответствующими энергиями активации
и соответствующими энергиями активации ![]() причем
причем ![]() —тепловой эффект реакции. При переходе от компактного металла к g-атомным частицам с избыточной энергией Vя (на г-атом) тепловой эффект реакции возрастет до
—тепловой эффект реакции. При переходе от компактного металла к g-атомным частицам с избыточной энергией Vя (на г-атом) тепловой эффект реакции возрастет до ![]() а энергии активации прямой и обратной реакции, в соответствии с соотношением линейности Бренстеда—Полани —Тёмкина [39], станут равными
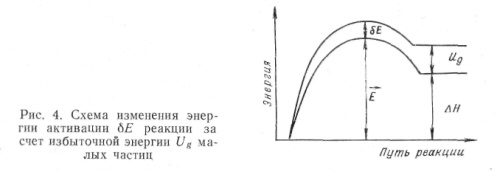
а энергии активации прямой и обратной реакции, в соответствии с соотношением линейности Бренстеда—Полани —Тёмкина [39], станут равными ![]() где α— трансмиссионный коэффицент, равный 1/2 при симметричной форме потенциального барьера реакции вблизи вершины (рис. 4).
где α— трансмиссионный коэффицент, равный 1/2 при симметричной форме потенциального барьера реакции вблизи вершины (рис. 4).
Таким образом, для скоростей реакции на малых частицах получаем:
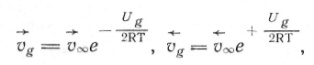 (4)
(4)
а общая скорость реакции, равная разности скоростей прямой и обратной реакций, составит:
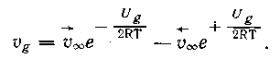 (5)
(5)
Это соотношение непосредственно показывает, что в условиях, близких к равновесным, например при не только снижается скорость реакции, но при ккал/г.атом (для Т = 423 К) даже направление реакции меняется на противоположное. Именно поэтому для образования новой фазы нужны «химические пересыщения» порядка 1010 для восстановления никеля; степень удаления от равновесия для g = 10 характеризуется отношением ![]() (!). Однако и в случае, когда скорость обратной реакции пренебрежимо мала и общая скорость выделения никеля определяется только первым членом правой части полученной формулы, снижение скорости для очень малых частиц также весьма значительно:
(!). Однако и в случае, когда скорость обратной реакции пренебрежимо мала и общая скорость выделения никеля определяется только первым членом правой части полученной формулы, снижение скорости для очень малых частиц также весьма значительно:

Обратим внимание на то, что «индукционный период», часто наблюдающийся в процессах химического осаждения как начальный этап очень медленного протекания реакции, имеет своей причиной низкую скорость не только зарождения новой фазы, но и протекания реакции на малых частицах.
Активация и катализ процессов химического осаждения
Из сказанного о механизме химического осаждения непосредственно следует, что любые агенты, облегчающие первичные реакции, реакционную агрегацию, коагуляцию или гетерогенную реакцию, должны ускорять и процесс химического осаждения в целом.
Наиболее известный путь ускорения процессов осаждения — введение «затравки» в виде частиц целевого продукта. Ее действие комплексное: на поверхности частиц затравки происходит гетерогенное зарождение к рост новой фазы; они служат центрами активированной и неактивированой агрегации и, наконец, обеспечивают ускорение гетерогенной реакции вследствие того, что размер частиц в присутствии затравки быстро достигает области, где химический размерный эффект сходит на нет.
В качестве активирующих добавок возможно также использование веществ, порождающих инородные твердые частицы, служащие в дальнейшем центрами кристаллизации. Таково введение сульфата железа при автоклавном восстановлении никеля из растворов [40]. В этом же процессе, но при использовании в качестве исходного вещества карбонатных или гидроксидных пульп никеля, частицы карбоната или гидроксида также действуют в качестве инородных затравочных частиц. По-видимому, ту же природу имеет и ускорение процесса восстановления никеля из аммиачно-сульфатных растворов «модифицированного» состава [41], т. е. с повышенным содержанием никеля и пониженным — сульфата аммония: первоначально в такой системе кристаллизуется двойной сульфат никеля и аммония, создающий дополнительную поверхность для гетерогенного зарождения фазы никеля.
В некоторых случаях удалось выявить и более тонкие механизмы действия активаторов химического осаждения. В частности, ускорение термического разложения карбонила никеля в присутствии сернистых соединений связано с образованием сульфид-карбонильных комплексов, что блокирует рекомбинацию трикарбонила в тетракарбонил по схеме (2) и, кроме того, может способствовать агрегации субкарбонильных осколков. Сера при этом входит в состав возникающей твердой фазы.
Сходным образом может быть объяснено ускорение гидролитического осаждения железа в присутствии малых добавок сульфат-иона: последний способствует агрегации гидроксокомплексов железа в тетраэдры (рис. 2,г); при этом центральный сульфат-ион оказывается связанным столь прочно, что не осаждается из раствора ионом бария [31]. Разумеется, как и в предыдущем случае, такое «структурирующее» действие не является собственно каталитическим.
По-видимому, случаи чисто каталитического действия, когда катализатор регенерируется после каждого пробега реакции, встречаются при химическом осаждении значительно реже, чем ускорение процесса с использованием активатора.
Можно предполагать, что к типу истинного катализа относится ускорение автоклавного восстановления никеля водородом в присутствии антрахинона-9, -10 [40]. Недавно электрохимически (циклическая вольтамперометрия) показано образование комплексов никеля с продуктами восстановления антрахинона; гипотетический механизм каталитической реакции включает образование и последующее восстановление до Ni° катион-радикального семихинонного комплекса никеля с регенерацией катализатора [42].
Зарождение и рост новой фазы на твердых поверхностях
Присутствие поверхностей полностью или частично направляет процесс образования новой фазы по пути выделения ее не в объеме, а на этих поверхностях, т. к. на твердой поверхности легче происходит зарождение и рост новой фазы. В зависимости от прочности связи между подложкой и возникающей фазой последняя может формироваться либо в виде двухмерных островков, либо путем зарождения трехмерных кластеров в «активных» точках. Образующиеся затем отдельные зерна сначала соединяются в цепочки, затем — в двухмерные блоки, а в конце концов смыкаются, спекаясь при достаточно высокой температуре в сплошную пленку.
Например, автоклавное выделение никеля при водородном восстановлении из растворов протекает на нержавеющей стали по первому механизму, а на графите — по второму [42]. Поверхностная концентрация одиночных частиц никеля на графите, определенная на уровне разрешения растровой электронной микроскопии (0,1-0,2 мкм), для различных условий составила от 107 до 109 см-2 [42].
Не установлено, отражает ли образование цепочек распределение исходных активных мест на поверхности графита или представляет результат взаимодействия поверхности с уже образовавшимися одиночными частицами. Известно [43], что первичные активные центры химического осаждения, выявляемые с помощью просвечивающей электронной микроскопии высокого разрешения, имеют поверхностную концентрацию 1010-1011 см и часто сгруппированы в «домены», образующие те или иные конфигурации на поверхности.
Сплошная пленка растет за счет гетерогенной реакции со скоростью, зависящей от толщины пленки. В этом случае также проявляется «химический размерный эффект», хотя, вероятно, не энергетической, а электронной природы (влияние толщины пленок на их электрические и магнитные свойства хорошо известно); возможно также влияние подложки [4]. Пример такой зависимости для скорости гетерогенного термического разложения карбонила никеля на нанесенных на стекло никелевых пленках показан на рис. 5. Эта зависимость аппроксимирована уравнением:
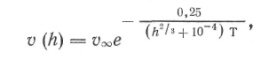 (6)
(6)
где h толщина пленки, см.
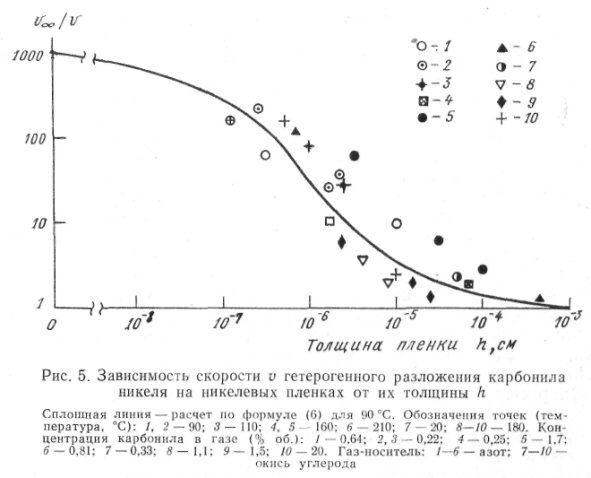
Существенно, что рост твердой фазы на поверхности часто происходит также за счет налипания твердых частиц, возникших в объеме. Учет взаимодействия между процессами на поверхности и в объеме необходим, в частности, для математического описания процессов химического осаждения.
Пути математического описания процессов химического осаждения в объеме
При образовании единственной твердой фазы возможна одномерная аппроксимация движения системы в пространстве состояний. Однако и в этом наиболее простом случае локальное описание процесса должно учитывать: первичную реакцию, дающую способные к агрегации мономеры; реакции агрегации по схеме типа (3); коагуляционный рост и гетерогенную реакцию на частицах, скорость которой зависит от их размера. Очевидно, что полное описание процесса в реальном аппарате должно включать весьма сложную картину смешения и нагрева, а также конкуренции между процессами на стенках и в объеме реактора. Математичекая модель, учитывающая все эти стороны сложного явления химического осаждения, пока отсутствует; даже для более простого случая, каким является образование аэрозолей при физической конденсации пара, такая модель еще не разработана [27]. Поэтому речь может идти лишь о тех или иных приближенных описаниях, сконцентрированных на той или иной стороне явления. Наиболее простой подход к этой задаче, первоначально применявшийся как единственный [5, 10], но и до сего времени не утративший своего значения, состоит в использовании классической теории физической конденсации. Действительно, для обратимых реакций химического осаждения, дающих одну фазу, таких как:
Ni(CO)4 = Ni тв + 4CO (7)
или
Ni 2+ + H2= Niтв + 2H+ (8)
можно ввести «химическое пересыщение», даваемое соотношением:
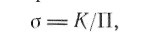 (9)
(9)
где К—константа равновесия; П — произведение фактических парциальных давлений и/или активностей. Например, для реакции (7)
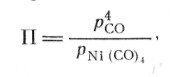 (10)
(10)
а для реакции (8)
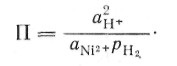 (11)
(11)
Выражение для избыточной свободной энергии Ggg-атомного зародыша по сравнению с компактной твердой фазой можно аппроксимировать простой формулой:
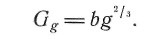 (12)
(12)
В случае частиц никеля Nig пригодность такой аппроксимации проверена [19].
Исходя из этих посылок, имеем выражения для величины критического зародыша:
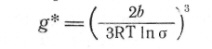 (13)
(13)
и для скорости зарождения частиц новой фазы:
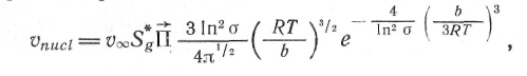 (14)
(14)
где Sg
* — эффективная площадь поверхности g-атомной частицы при g = g*; для никеля найдено [19]:
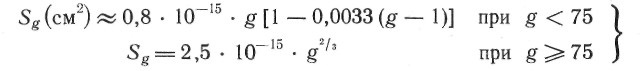 (15)
(15)
— -– произведение активностей исходных веществ: для реакции 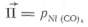 (7); для реакции
(7); для реакции 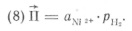
Определение величины g* критического зародыша для двух рассматриваемых реакций показывает, что в случае термического раз-ложениия карбонила никеля при температурах и концентрациях, типичных для технологии (T = 450-550 K, PNi(CO)4 » 0,5 ат), g* менее 1, т. е. посылки классического подхода оказываются нереалистичными. В случае же водородного восстановления никеля вычисленные для рабочих условий размеры критического зародыша составляют g* ≈ 101, что указывает на возможность использования классического подхода к математическому описанию процесса.
Простейшее описание процесса, построенное на этой основе, включает два дифференциальных уравнения: для изменения счетной N и весовой М концентрации частиц в объеме:
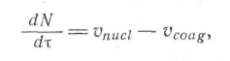 (16)
(16)
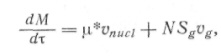 (17)
(17)
где m* — масса критического зародыша.
Средний размер частиц g в любой момент времени определяется отношением M/N; начальные условия для решения этой системы очевидны: при t = 0, П = П0, М = М0, N = N0, т. е. равны, соответственно, массе и числу частиц введенной затравки в единице объема. Скорость коагуляции задается простейшим выражением:
Vcoag = Kcoag.N2 (18),
где коэффициент коагуляции Kcoag —«подгоночный» параметр, определяемый из опыта; Sg и vg рассмотрены выше — формулы (15) и (5).
Преимуществом такого описания является крайняя простота, делающая его пригодным для быстрых качественных оценок роли разных факторов в общей картине процесса.
Для процесса термического разложения карбонила в объеме физико-химические закономерности стадий изучены подробно, поэтому оказалось возможным построение «микрокинетического» описания, содержащего уравнения для кинетики:
—обратимой диссоциации карбонила никеля до трикарбонила;
—активированной агрегации;
—газокинетической и направленной (магнитной) коагуляции;
—гетерогенной реакции на частицах со скоростью, зависящей от их размера [23, 25].
Это описание относится к изотермическому процессу в отсутствие внешнедиффузионных ограничений. Основой его является система дифференциальных уравнений типа коагуляционных. Принципиально важно, что в модели предусмотрено описание «достаточно больших» (с g³ 13) частиц путем объединения их в группы, характеризуемые общей массой и общей счетной концентрацией. Это позволяет характеризовать группу парой уравнений: для изменения счетной концентрации и для изменения массы. Последнее делает возможным учет зависимости скорости гетерогенной реакции от размера (среднего для данной группы).
Из рис. 6 видно, что наблюдаемое в эксперименте типичное развитие процесса неоавномерно. Вначале устанавливается квазиравновесие
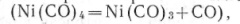
возникающее вследствие кинетической затрудненности агрегации трикарбонила; в течение этой стадии происходит постепенное накопление крупных частиц, что обусловливает переход к лавинообразной незатрудненной агрегации. Соотношения между вкладами этих главных этапов различны для разных температур и концентраций; поэтому наблюдаемые кинетические характеристики суммарной реакции сильно изменяются с условиями: в частности, наблюдаемые значения энергии активации находятся в широком интервале от 5 до 62 ккал/моль.
Построенная математическая модель оказалась способной отразить эти особенности процесса.
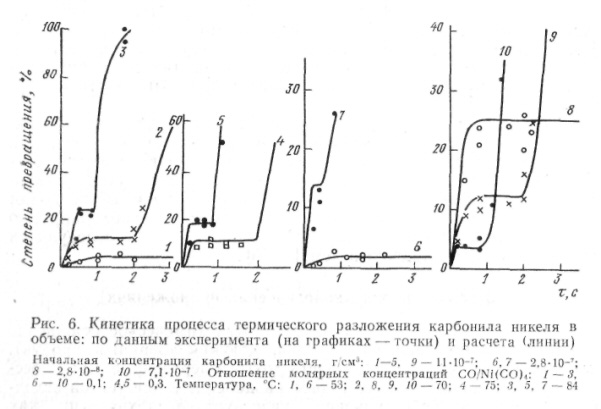
Для сложного случая с осаждением аэрозоля на стенки реактора достигнуто совпадение расчета и эксперимента по порядку величины [23]. Однако даже для этого, наиболее подробно изученного процесса не удалось разработать модель, которая позволила бы предсказать распределение по размерам частиц порошка, получаемого в промышленном аппарате, т. к. в этом случае на описанную кинетику накладывается влияние неизотермического смешения потоков.
Попытки математического описания более сложных процессов, таких как гидролитическое осаждение железа (III), пока неизвестны. По-видимому, для таких случаев могли бы оказаться эффективными подходы, развитые применительно к поликонденсации [44, 45]; их использование предполагает знание термодинамики и кинетики элементарных стадий агрегации, доныне почти не изученных.
Математическое описание химического осаждения на поверхностях, с одной стороны, осложнено неоднородностью поверхности и ее влиянием на зарождение новой фазы; однако с другой стороны допускает упрощенные подходы к процессу как к обыкновенной гетерогенной реакции, обычно с индукционным периодом [1, 2, 5, 7, 9]. Серьезные трудности связаны с необходимостью учета взаимодействий подложки с покрытием и последующих структурных превращений в нем [7, 46].
О возможных технологических приложениях
В никель-кобальтовой промышленности химическое осаждение может составлять целевой передел, дающий товарный продукт, или выступает как составная часть другого передела, обычно обеспечивающая полное или частичное разделение компонентов исходного материала; либо, наконец, участвует в технологии как осложняющее явление.
Полученные результаты делают общую картину химического осаждения более понятной и позволяют дать технологу полезные указания. В частности, при получении никелевых порошков карбонильным способом возможно воздействовать на их свойства путем изменения условий коагуляции аэрозоля.
Для получения крупных сферических частиц необходимы, с одной стороны, ускорение спекания, а с другой — увеличение критического размера частиц, начиная с которого коагуляция становится направленной. И то и другое может быть достигнуто повышением температуры в средней и нижней частях аппарата.
Возникающая при этом в аппарате циркуляция газовзвеси также существенно влияет на размер частиц. Восходящие потоки возвращают частицы никеля в зоны с более низкой температурой и более высокой счетной концентрацией; таким образом ускоряется рост частиц за счет «магнитной» коагуляции. С другой стороны, высокая температура в нижней части аппарата способствует быстрому внутриагрегатному спеканию; в результате образуются так называемые «тяжелые» порошки, с большим насыпным весом и сферическими частицами.
Напротив, перегрев верхней зоны аппарата по сравнению с нижними дает обратный эффект, т. е. приводит к образованию цепочечных агрегатов высокодисперсных частиц — так называемых «легких» порошков и даже «ваты».
Действительно, резко падающая температура облегчает магнитную коагуляцию и замедляет внутриагрегатное спекание. Кроме того, падающий температурный режим, подавляя конвективные токи по высоте аппарата, обеспечивает большую однородность размера частиц порошков. Этой же цели должно способствовать уменьшение свободного сечения, по которому идет поток реакционной смеси, — например, применение вставки в виде широкой трубы по оси реактора (конструкция запатентована). На скорость спекания и порог направленной коагуляции можно воздействовать также введением в газ веществ, изменяющих поверхностную подвижность атомов никеля или — при растворении в нем — влияющих на магнитную восприимчивость. Этот вариант сопряжен с изменением состава порошка и может явиться эффективным для получения новых карбонильных материалов.
Некоторые возможности направленного изменения свойств автоклавных никелевых порошков, определяемые взаимодействием зарождения, коагуляции и внутриагрегатного спекания в ходе получения порошка, рассмотрены в [37].
Предложенная общая схема гидролитического осаждения железа по нескольким путям позволяет сделать вывод о возможности влиять на выбор системой одного из путей посредством слабых энергетических воздействий, в частности магнитными полями. Действительно, удалось достичь укрупнения структуры и ускорения оседания неферромагнитых гидролитических осадков железа при формировании их в неоднородных магнитных полях [30].
Одним из прикладных результатов проведенных исследований является выяснение общего механизма образования отложений и настылей на стенках гидрометаллургической аппаратуры. Показано, что отложения являются, как правило, продуктом совместного протекания двух процессов: гетерогенного химического осаждения и налипания на стенку твердых частиц из объема. Этот механизм установлен на примере металлизации стенок автоклава при водородном восстановлении никеля из растворов [41] и подтвержден для случая образования настылей при нейтрализации хвостов серосульфидной флотации в схеме окислительного автоклавного выщелачивания пирротиновых концентратов. Выяснено, что кристаллизация гипса и гидролитическое осаждение железа на стенках сочетаются с налипанием на них твердых частиц пульпы, что и ускоряет рост отложений. Следовательно, для предотвращения или снижения скорости образования отложений необходимо предусматривать не только замедление гетерогенных реакций на стенках, но и организацию потоков, препятствующую налипанию твердых частиц.
В целом теоретическое изучение рассматриваемых процессов позволяет не только объяснить смысл приемов, уже найденных эмпирически, но и дать технологам направление для совершенствования существующих и разработки новых процессов.
ЗАКЛЮЧЕНИЕ
Изучение любой реакционной системы представляет собой индивидуальную задачу, при решении которой необходимо, в первую очередь, учитывать специфику именно этой системы. Однако полезно использовать и некоторые общие подходы, определяемые природой химического осаждения как процесса одновременного протекания и взаимодействия первичной реакции, агрегации мономеров, переходящей в коагуляцию, а также гетерогенной реакции на частицах новой фазы со скоростью, зависящей от их размера.
Для применения и развития этих общих подходов необходимы дальнейшие теоретические исследования, в особенности, в следующих направлениях:
—изучение физики и химии кластеров-предшественников новых фаз. «Наука о кластерах» [46] ныне интенсивно развивается [47, 48], но кластеры-предшественники новых фаз, возникающих в химической реакции, остаются трудным объектом и не рассматриваются в основной массе исследований.
Эффективными методами для устранения этого пробела могли бы стать масс-спектрометрия высокого разрешения (для газов), радиоспектроскопия, а также ЯГР-спектроскопия при гелиевых температурах (для растворов);
—разработка теории агрегационных процессов. Одним из результатов проведенных исследований является установление роли процессов агрегации и коагуляции в образовании новых фаз при химических реакциях. Поэтому развитие теории химического осаждения во многом определяется возможностями адекватного описания таких процессов. По-видимому, наиболее совершенным из ныне известных является аппарат теории фракталов — самоподобных объектов с дробной размерностью [49]; в ряде случаев его использование для описания процессов агрегационного роста частиц оказалось успешным [50, 51]. К сожалению ограничение, налагаемое условием самоподобия, делает этот аппарат пригодным для описания лишь некоторых этапов агрегации, и пока остается ждать от математической науки дальнейшего усовершенствования способов описания агрегационных процессов. Некоторой альтернативой, возможно, является численное моделирование агрегационного роста на быстродействующих компьютерах, без наложения условиях самоподобия [27]. Напомним также о возможностях использования аппарата, развитого в теориях полимеризации;
— макрокинетика процессов химического осаждения. Это особое направление теоретических исследований, почти не затронутое выше, могло бы существенно продвинуться при использовании результатов, достигнутых в теории ракетных двигателей, подводного судостроения и т. п. областях. В настоящее время опубликованы лишь небольшие фрагменты этих разделов науки [52];
— исследования корреляции между первичными и потребительскими характеристиками продуктов химического осаждения. В этой области, где соприкасаются теоретические основы многих отраслей техники, требуется сотрудничество специалистов разного профиля. Некоторый фактический материал, пока крайне недостаточный, накоплен только для металлических порошков [53, 54, 55].
ЛИТЕРАТУРА
1. Дорфман В. Ф. Газофазовая микрометаллургия полупроводников.— М.: Металлургия, 1974.
2. Кристаллизация тугоплавких металлов из газовой фазы/В. Е. Иванов Е. О.
Нечипоренко, В. М. Криворучко, В. В. Сагалович. — М.: Атомиздат, 1974.
3. Теснер П. А. Образование углерода из углеводородов газовой фазы — М.: Химия, 1972.
4. Теснер П. А. Кинетика образования пироуглерода.— М.: ВИНИТИ 1987.
5. Дерягин Б. В., Федосеев Д. В. Рост алмаза и графита из газовой фазы.— М.: Наука, 1977.
6. Федосеев Д. В., Семенова-Тянь-Шанская А. С. Кристаллизация алмаза.— .: Наука, 1984.
7. Осаждение пленок и покрытий разложением металлорганических соединений/Б. Г.
Грибов, Г. А. Домрачев, Б. В. Жук и др.—М.: Наука, 1981.
8.Вассерман И. М. Химическое осаждение из растворов. — Л.: Химия 1980.
9. Химическое осаждение металлов из водных растворов/В. В. Свиридов, Т. Н.
Воробьева, Т. В. Гаевская, Л. И. Степанова . — Минск: Изд-во «Университетское», 1987.
10. Осаждение из газовой фазы/Под ред. К. Пауэлла, Дж. Оксли и Дж. Блочера мл. (пер. с
англ.).—М.: Атомиздат, 1970.
11. Фольмер М. Кинетика образования новой фазы. (пер. с нем.).— М.: Наука, 1986. .
12. Френкель Я. И. Кинетическая теория жидкостей.— Л.: Наука, 1975. .
13. Кипнис А. Я. Кластеры в химии. — М.: Знание, 1981.
14. Кипнис А. Я. О классификации кластеров в химии//Изв. СО АН СССР. Сер. хим.
— 1982. Вып. 4. с. 47—54.
15. Петров Ю И. Физика малых частиц—М.: Наука, 1982.
16. Петров Ю. И. Кластеры и малые частицы. — М.: Наука, 1986. .
17. Губин С. П. Химия кластеров. — М.: Наука, 1987.
18. Кипнис А. Я., Федорова 3. П. Масс-спектрометрическое исследование термического разложения карбонила никеля//Кинетика и катализ, 1978. Т. 19. Вып. 4. с. 848—852.
19.Кипнис А. Я., Рюмшин А. Е. Термодинамические характеристики кластеров никеля //Гипроникель. Л., 1978. 9 с. Деп. в ЦНИИцветмет экономики и информации, № 371—78.
20. Кипнис А. Я, Михайлова Н. Ф., Померанцева Л. А. Термодинамические характеристики моно- и биядерных субкарбонилов никеля// Гипроникель. Л. 1976. 13 с. Деп. в ВИНИТИ, № 32—77.
21. Термодинамические характеристики кластеров — многоядерных субкарбонилов никеля и малых частиц никеля, стабилизированных адсорбцией окиси углерода //А. Я. Кипнис, Н. Ф. Михайлова, Л. А. Померанцева, А. Е. Рюмшин //Гипроникель. Л., 1976. 9 с. Деп. ВИНИТИ, № 4152—76.
22.А. с. 416079 СССР. МКИ3 BOI 1/14. Аппарат для получения высокодисперсных частиц.
23. Кинетика и механизм термического разложения карбонила никеля в объеме/А. Я. Кипнис, Н. Ф. Михайлова, Л. А. Померанцева, А. Е. Рюмшин//Л., 1979. 53 с. Деп. в ВИНИТИ, № 2714—79.
24. Кипнис А. Я., Myравин К. А., Немойтин М. А. Исследование порошков карбонильного никеля электронномикроскопическим методом //Порошковая металлургия. 1971. № 4 (100). с. 8—12.
25. Рюмшин А. Е., Кипнис А. Я. Математическая модель процесса химической кристаллизации в объеме газа//Гипроникель. Л., 1978. 43 с. Деп. в ВИНИТИ, № 2889—79.
26. Кипнис А. Я., Рюмшин А. Е. Закономерности химической кристаллизации в объеме газа по данным математического моделирования//Гипроникель. Л., 1981. 46 с. Деп. в ВИНИТИ, № 732—81.
27. Петрянов И. В., Сутугин А. Г. История развития представлений о процессах образования конденсационных аэрозолей и их современное состояние//Коллоидный ж., 1989. Т. 51. № 3. с. 480—489.
28. Крестинин А. В., Смирнов В. Н., Заслонко И. С. Кинетическая модель разложения Fe(CO)s и конденсации железа за ударной волной// Химич. физика, 1990. Т. 9, № 3. С. 418—425.
29. Baes Ch. F., Mesmer R. E. The hydrolysis of cations.— N. Y.: Wiley—Interscience, 1976. .
30. Исследовать физико-химические свойства расплавов и растворов и закономерности их взаимодействия в процессах никель-кобальтового производства. Т. II. Гидрометаллургические исследования: Отчет о НИР (заключ.) /Гипроникель; Руководитель А. Я. Кипнис . Шифр темы 3-79-013т, № ГР 79012533. Инв. № Б 883100., Л. 1980. 116 с.
31. Кипнис А. Я., Наймарк И. А., Иоффе П. А. Конкурирующие процессы в кинетике глубокого термического гидролиза в сульфатных средах// Термодинамика и структура гидроксокомплексов в растворах/Тез. докл. на III Всес. совещание: Душанбе, окт. 1980 г.— Л.: Наука, 1980. С. 98.
32. Кипнис А. Я., Наймарк И. А. Последовательные и параллельные процессы образования полиядерных комплексов при гидролизе железа (Ш)//Тез. докл. на XIV Всес. Чугаевском Совещании по химии комплексных соединений. Иваново, 1981 г.—Иваново, 1981. С. 357.
33. Cornell R. M., Giovanoli R., Schneider N. Review of the hydrolysis of -iron (III) and the crystallization of amorphous iron (III) hydroxide hydrate//J. Chem. Technol. a. Biotechnol, 1989. V. 46, № 2, p. 115—134.
34. Звягинцев О. Е., Лопатто Ю. С. Четырехядерные оксигидроксо-комплексные соединения трехвалентного железа//ЖНХ, 1961. Т. 6, № 4. С. 863—869.
35. Spiro Т. G. et al. The hydrolytic polymerization of iron (III). J. Amer. Chem. Soc, 1966, vol. 88, № 12, p. 2721—2726; also Biochemistry, 1968, vol. 7, № 6, p. 2185—2192.
36. Левитин И. Л. Массовая кристаллизация из растворов: Математическое моделирование и экспериментальные данные.— М.: НИИТЭХИМ. 1987 .
37. Волкова Г. А., Кипнис А. Я., Салтыкова Е. Г. Пути воздействия на свойства автоклавных порошков никеля в процессе их формирования//Современные тенденции развития технологии никель-кобальтового производства. — Л., 1989. С. 80—90. (Сб. науч. тр./Гипроникель).
38. Буянов Г. А., Криворучко О. П. Разработка теории кристаллизации малорастворимых гидроокисей металлов//Кинетика и катализ. 1976. Т. 17, вып. 3. С. 765—775.
39. К и п е р м а н С. Л. Введение в кинетику гетерогенных каталитических процессов.—М.: Наука, 1964. С. 108.
40. Matsuda K., Majima H. Reduction of nickel from ammoniacal nickel sulfate solution with dissolved molecular hydrogen//The Mining a. Metallurgical Inst, of Japan, 1981. vol. 97, № 1118, p. 257—262.
41. Кипнис А. Я., Муравчик Б. Л., Салтыкова Е. С. Особенности автоклавного восстановления никеля из аммиачно-сульфатных растворов//Современные тенденции развития технологии никель-кобальтового производства. — Л. 1989. С. 69—80. (Сб. науч. тр./Гипроникель).
42. Физико-химическое изучение формирования композиционных никельсодержащих порошков при автоклавном восстановлении никеля из водных растворов: Отчет о НИР (заключ.)/Гипронкель: Руководитель А. Я. Кипнис . Шифр темы 3-89т-073т, № ГР 0189.0054249, Инв. № 0291.0007600. Л., 1990. 118 с.
43. Дистлер Г. И. и др. Декорирование поверхности твердых тел.— М.: Наука, 1976.
44. Кучанов С. И. Методы кинетических расчетов в химии полимеров.— М.: Химия, 1978.
45.Силинг М. Поликонденсация. Физико-химические основы и математическое моделирование. — М.: Химия, 1988.
46. Knight W. D. Recent developments in cluster science.— Physica scr. T. 1989, vol. 29, p.20—23.
47. Microclusters/ S. Sugano, Y. Nishina, S. Ornishi. Eds.— Berlin: Springer, 1987.
48. Small Particles and Inorganic Clusters. Proc. Intern. Meeting. //Z. Physik, D., 1989. Bd.. 12, № 1—4. S. 1—607.
49. Фракталы в физике.— M.: Мир, 1988. 670 с.
50. Meakin P. The growth of fractal aggregates and their fractal measures//Phase transitions and critical phenomena, Vol. 12, L., 1988, p. 335—489.
51.Терехов А. Г., Нуржанова С. Б. Агрегация и фрактальные структуры полиядерных ионных форм ванадия (V)//ДАН СССР, 1989. Т. 309, № 5. С. 1174—1176.
52. Прудников А. Г., Волынский М. С, Сагалович В. Н. Процессы смесеобразования и горения в воздушнореактивных двигателях.— М.: Машиностроение, 1971.
53. Диагностика металлических порошков/ В. Я. Буланов, Л. И. Кватер, Т. В. Долгаль и др.//М.: Наука, 1983. .
54. Морохов И. Д., Трусов Л. И., Чижик С. П. Ультрадисперсные металлические среды. — М.: Атомиздат, 1977.
55. Морохов И. Д., Трусов Л. П., Лаповок Л. Н. Физические явления в ультрадисперсных средах. — М.: Энергоатомиздат, 1984.
