Kipnis A. Ya., Michailova N. F., Pomeranzeva L. A., Rumshin A. E.
Kinetics and mechanism of thermal decomposition of nickel tetracarbonyl
with the formation of nickel aerosols
Ni (CO)4 = Ni (CO)3 + CO
Nig(CO)x + Nij(CO)y → Nig+j(CO)z + (x + y - z)CO
g, j = 1, 2, 3, ...
It is suggested that the activation energy for aggregation would fall from 9 kcal/mole at g + j = 2 to zero at g + j ≥ 13.
А. Я. Кипнис, Н. Ф. Михайлова, Л. А, Померанцева, А. Е. Рюмшин
МЕХАНИЗМ И КИНЕТИКА ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ ТЕТРАКАРБОНИЛА НИКЕЛЯ В ОБЪЕМЕ
Статья депонирована в ВИНИТИ в 1979 : № 2714-79;
реферат
опубликован в "Журнале прикладной химии" 1980, 53, №6, с. 1439-1440
I. ВВЕДЕНИЕ
Термическое разложение карбонила никеля (КН) в объеме с получением никелевых порошков имеет существенное прикладное значение. Вместе с тем этот процесс является характерным примером "химической кристаллизации" из газовой фазы и с этой точки зрения его исследование представляет более общий теоретический и практический интерес.
Несмотря на то, что термическому разложению КН в объеме посвящен ряд исследований [1-7] (см. табл.1), сведения о закономерностях процесса неполны и противоречивы. Это обусловлено различиями в условиях проведения упомянутых исследований, а также тем, что в большинстве работ наблюдали лишь суммарнуюскорость сложного процесса, причем в условиях, когда все его стадии, в том числе и заключительные, получали значительное развитие.
В настоящей работе излагаются результаты комплексного исследования термического разложения КН в объеме; применены следующие методы: I) измерение кинетики с применением специально разработанных проточных дифференциальных реакторов, обеспечивающих наблюдение результатов процесса при малых временах разложения (от 0,02 до 3 сек); 2) измерение счетной концентрации и размера частиц образующегося аэрозоля никеля; 3) электронно-микроскопическое исследование твердых продуктов разложения; 4) математическое моделирование процесса на ЭЦВМ как средство расшифровки наблюдаемых экспериментально зависимостей.
Ранее по результатам расчета равновесий гомогенной диссоциации КН и существующим литературным данным была намечена общая схема процесса [8]; рассмотрены возможные пути его математического описания [9] и разработана математическая модель процесса, основанная на его микрокинетическом описании [10, 11, 12]. Результаты этих работ использованы для обсуждения и анализа экспериментальных данных.
2. МЕТОДИКА ИССЛЕДОВАНИЯ
При разработке методики кинетических измерений ставили задачу определения за данное время как степени превращения КН, так и числа и размера возникших частиц. Наблюдение ранних стадий развития процесса возможно при выполнении по крайней мере двух условий. Во-первых, необходимы весьма большие разбавления пара КН: в противном случае образующийся аэрозоль быстро скоагулирует. Во-вторых, время пребывания веществ в реакторе должно быть настолько кратким, чтобы достигнутая за это время степень превращения оставалась невысокой.
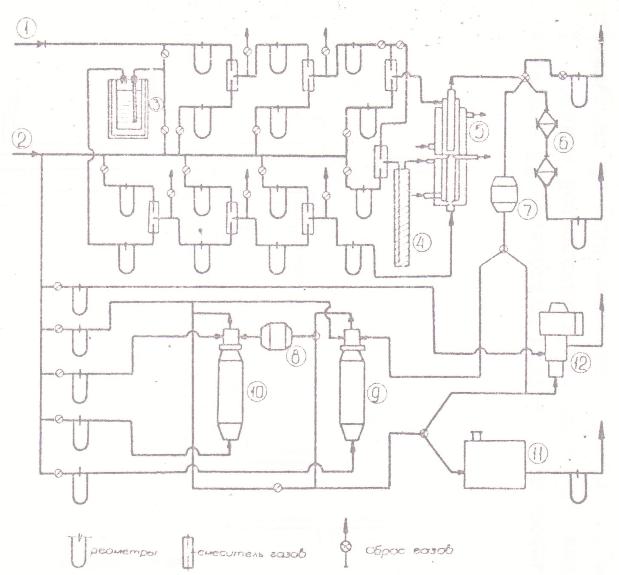
Для того, чтобы удовлетворить этим требованиям, использовали проточные дифференциальные реакторы с малым объемом реакционной камеры, и образующийся аэрозоль никеля исследовали в потоке, определяя его весовую и счетную концентрацию. Общая схема установки показана на рис.1; установка включает в себя последовательно размещенные по ходу потока устройства для очистки, нагрева и дозирования газов; реакционный аппарат; измерительную систему для исследования аэрозоля.
Техника исследования аэрозолей была аналогична описанной в работах [13-15]. Весовую концентрацию аэрозолей определяли, удавливая частицы никеля фильтрами Петрянова [16] с последующим сжиганием фильтра, растворением осадка и колориметрическим определением диметилглиоксимата никеля. При времени накопления осадка на фильтре 10 мин можно было измерять до 10-10 г Ni в 1 см3.
Степень превращения находили по соотношению между количеством никеля, найденным на фильтре, и количеством никеля, введенным в реактор в виде КН.
Для определения счетной концентрации её предварительно снижали пропусканием аэрозоля через одни или два неселективных "разбавителя" [17], в которых из определенной (большей) части потока аэрозоля отфильтровывались твердые частицы. Кратность снижения счетной концентрации можно было изменять от 10-20 до3000-5000 раз.
Коммуникации до фильтров и до "разбавителей" стремились сделать идентичными по геометрическим характеристикам, т.е. по сечению, длине и конфигурации.
Чтобы сделать возможным ультрамикроскопическое наблюдение и счет весьма малых частиц, их предварительно "проявляли" (укрупняли) конденсацией на них пересыщенных паров стеариновой кислоты, а затем диизобутилфталата в двух последовательно установленных конденсационных укрупнителях типа КУСТ [18]. Для счета частиц применяли прибор системы ЛенНИИ Гигиены труда и профзаболеваний, представляющий собой проточный ультрамикроскоп с приспособлением для счета частиц в момент кратковременной остановки потока [19, 20]. Для определения одного
значения счетной концентрации производили 45-50 отсчетов; при работе вдвоем измерение продолжалось около 1 мин. Для предварительного полуколичественного контроля счетной концентрации аэрозоля использовали нефелометр КОЛ-45 [21], Это позволяло быстро корректировать или изменять режим.
Газы в систему подавали после тщательной очистки от кислорода на активной меди и от пыли на фильтрах Петрянова (узлы очистки не показаны ка схеме рис. 1); кроме того, оказалась необходимой тщательная подготовка всех коммуникаций. Полноту очистки газов контролировали холостыми измерениями: потоки горячих разбавляющих газов без КН и пар КН без нагрева не показывали фона в нефелометре и счета в ультрамикроскопе.
Парогазовую смесь с низкой концентрацией КН получали путем многократного разбавления насыщенного пара КН азотом или окисью углерода. В качестве насытителя служил термостатированный контейнер для жидкого КН, снабженный насадкой; последняя предотвращала унос жидкого КН в виде мелких капелек. Температуру насыщения изменяли от 0 до 25°С, поток газа-носителя, подаваемого в насытитель, составлял 20-40 см3/мин. Чтобы общий поток карбонилсодержащего газа, подаваемого в реактор, оставался примерно таким же, перед каждым разбавлением большую часть потока сбрасывали. От одного до трех сбросов и разбавлений было достаточно, чтобы концентрация КН на входе в реактор (перед смешением с горячим азотом) составляла от 10-5 до 10-10 г/см3.
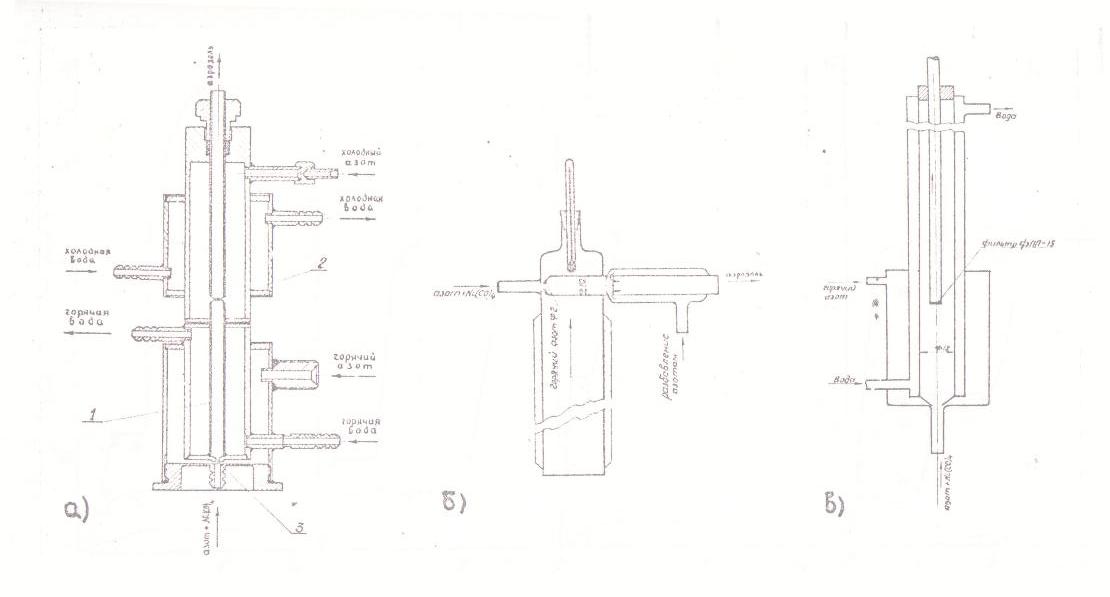
На рис.2 показаны схемы реакторов, использованных для кинетических измерений [22]. На входе в реактор малый поток разбавленного пара КН, подаваемый вдоль оси реактора, в щелевом сместитеде пересекается радиально направленным потоком горячего азота, обычно в 20-100 раз превосходящим осевой поток. Время смешения оценивается в 10-4 - 10-3 сек. В вариантах реакторов «а» и «б» на выходе из реакционного пространства реакция прерывается за счет смешения с холодным азотом, и аэрозоль поступает на определение весовой и счетной концентрации.
В варианте «в» аэрозоль полностью улавливается на выходе из реакционной зоны. В этом варианте счетная концентрация не измеряется, но обеспечивается надежное определение степени превращения, свободное от погрешности за счет осаждения аэрозольных частиц на стенках реактора и коммуникаций. С помощью этого реактора можно было изменять время пребывания парогазовой смеси в реакционном объеме при полном постоянстве условий смешения потоков; для этого перемещали вдоль оси реактора отводящую трубку с фильтром. Диапазон изменения времени контакта - от 0,2 до 2,2 сек - обеспечивал возможность достижения измеримых степеней превращения при низких температурах. Можно было опасаться ошибки за счет вклада гетерогенной реакции на фильтре и, тем более, на частицах никеля, однако, оценки величины этой ошибки (в предположении, что реакция протекает на частицах как на компактном никеле) показали, что в рабочем диапазоне температур (ниже 90°С) возможная погрешность пренебрежимо мала.
В некоторых измерениях, направленных на наблюдение более поздних стадий процесса, использовали также простые стеклянные реакторы без щелевого смесителя (требования к быстроте смешения можно было снизить вследствие большой продолкительности времени пребывания в этих реакторах). В одном из них карбонилсодержащую парогазовую смесь подавали в тройник перпендикулярно к основному потоку горячего азота («тройниковый» реактор с объемом реакционного пространства 38 см3). В другом реакторе (сферическом с объемом 260 cм3) радиальный поток парогазовой смеси пересекался перпендикулярным к нему потоком горячего азота. Эти реакторы использовали в опытах, в которых получали крупные (ультрамикроскопического размера) частицы; для определения их счетной концентрации аэрозоль из реактора направляли непосредственно на проточный ультрамикроскоп. Кроме того, в этих реакторах проводили опыты разложения КН при более высоких концентрациях, что позволяло получать пробы карбонильного никеля в количествах, достаточных для последующего злектронно-микроскопического исследования.
Электронно-микроскопический метод исследования аэрозольных частиц никеля был использован как дополняющий поточные методы. Это обеспечило независимое и прямое определение размера частиц никеля и дало сведения для суждения о процессе их коагуляции.
Изучали два типа объектов. Для исследования частиц, образующихся при низких концентрациях, отбирали пробы из потока аэрозоля на выходе из реакторов. Для этого в соответствии с [23] в поток вводили приклеенную к охлажденному металлическому держателю медную сеточку диаметром 3 мм (такие сеточки служат стандартной основой для дисперсных объектов, на которой последние вводятся в камеру электронного микроскопа). Время выдержки при отборе проб составляло от 1 до 50 сек. Пробы отбирали в двух местах - на выходе из реактора и на входе в первый из приборов КУСТ. Полученные таким образом объекты непосредственно после опыта исследовали с помощью просвечивающего электронного микроскопа "Тесла" В5-242 с разрешающей способностью не хуже 40А.
Опыт показал, что при отборе проб непосредственно после реактора (даже при очень коротком времени экспозиции) на сеточке накапливается много частиц, которые быстро срастаются в большие агрегаты; спеканию способствует и облучение электронным пучком в процессе наблюдения. Поэтому представление о размерах частиц удалось получить только при отборе проб из потока после разбавителей перед первым из приборов КУСТ. Правда, и в этом случае осложнения, связанные со спеканием частиц в электронном пучке, оставались, так что данных, достаточных для построения распределения частиц по размерам, получить не удалось. Все же результаты этих измерений были весьма существенны для целей настоящей работы, так как они дали представление о диапазоне размеров частиц никеля и, что оказалось особенно важным, о характере их агрегации.
Другой тип объектов - пробы порошкообразного карбонильного никеля, которые собирали на выходе из тройникового и сферического реакторов. Эти пробы препарировали по методике, предложенной М. А. Немойтиным [24]: крупные частицы осаждали из взвеси в спирте, а отмученную мелкую фракцию (около 50 мг), 40-50 мин растирали в пленочном растворе (0,5% парлодиона в амилацетате) и затем каплю такой суспензии наносили на поверхность воды в чашке Петри; при растекании капли взвешенные в суспензии частички никеля разбегались вместе с жидкостью и после испарения растворителя оказывались включенными в пленку-подложку на таком расстоянии друг от друга, что спекание их в электронном пучке было исключено.
Измерения, проведенные на этих объектах, дали дополнительные и достаточно надежные сведения о размерах и характере агрегации частиц никеля при разложении КН в объеме.
Параллельно с кинетическими измерениями проводили исследование процесса методом математического моделирования (подробнее см. 4).
Опыт работы и результаты расчетов показали, что ни в одном из вариантов проведения реакции не удается освободиться от или иных осложнений или ограничений. При быстром смешении и малом времени контакта, когда велико отношение поверхности реактора к объему и растет погрешность за счет осаждения частиц на стенках, уменьшение этой погрешности сопряжено либо с замедлением смешения (этот путь был проверен в опытах с тройниковыми реакторами), либо с отказом от измерения концентрации частиц (реактор по схеме рис.2в). Тем не менее, работа с применением всех этих реакторов и с привлечением остальных методов позволила получить достаточно полное представление о закономерностях протекания процесса.
3. ЭКСПЕРИМЕНТАЛЬНЫЕ ДАННЫЕ
На разных реакторах и в различных режимах было проведено свыше 400 опытов; в табл. 2 приведены типичные примеры серий измерений, показывающие значения параметров экспериментов и измеряемых характеристик процесса.
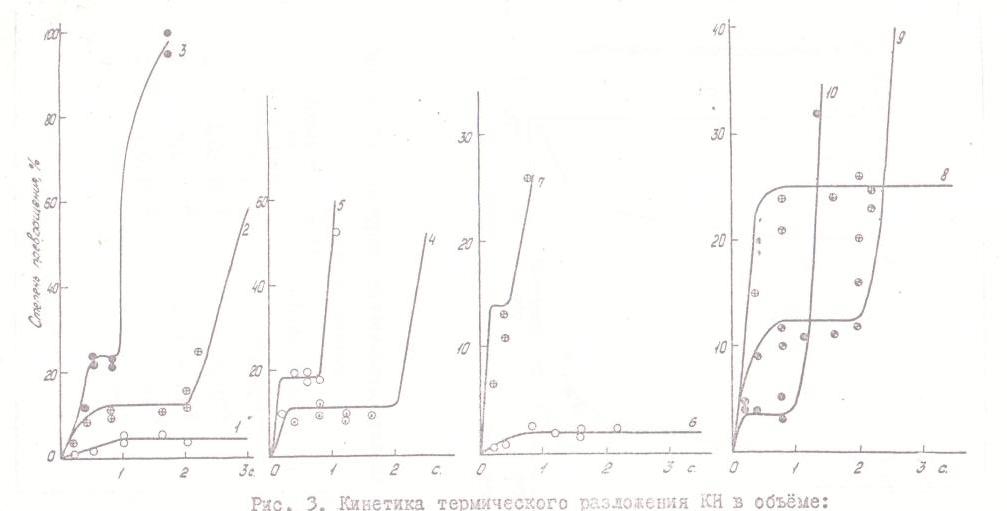
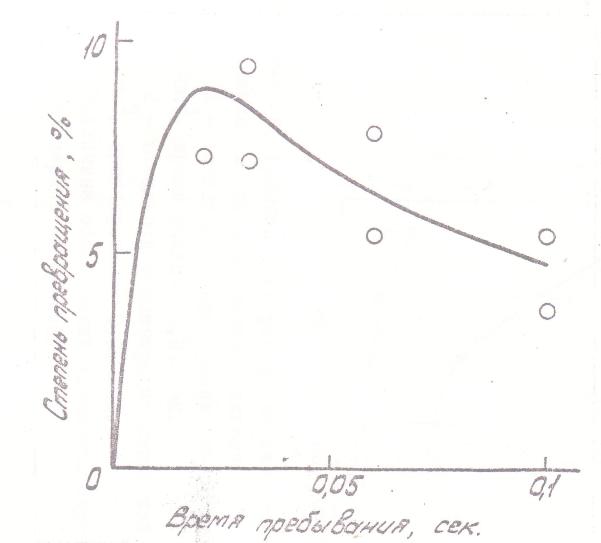
При рассмотрении данных о зависимости степени превращения от условий обращают на себя внимание две особенности. Первая заключается в существовании квазиравновесного этапа развития реакции, который особенно отчетливо проявляется при низких температурах; в некоторых случаях за время наблюдения (до 2 сек) система даже не успевает выйти из этого квазиравновесного состояния (см. рис. 3). Эта особенность реакции ранее, по-видимому, не наблюдалась, что объясняется трудностью ее обнаружения при использовании статических реакторов со временем установления начальных условий свыше 1 сек.
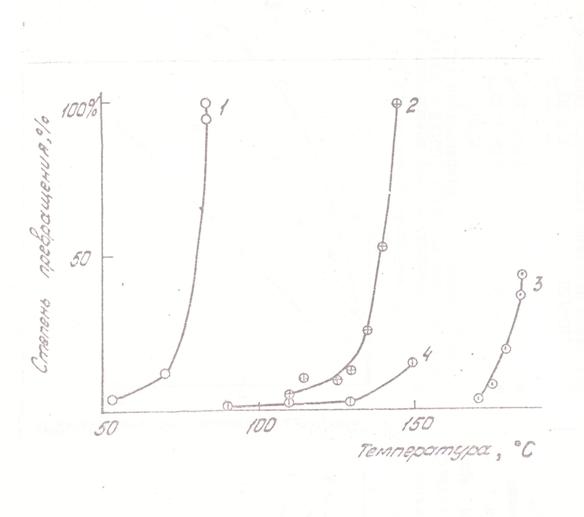
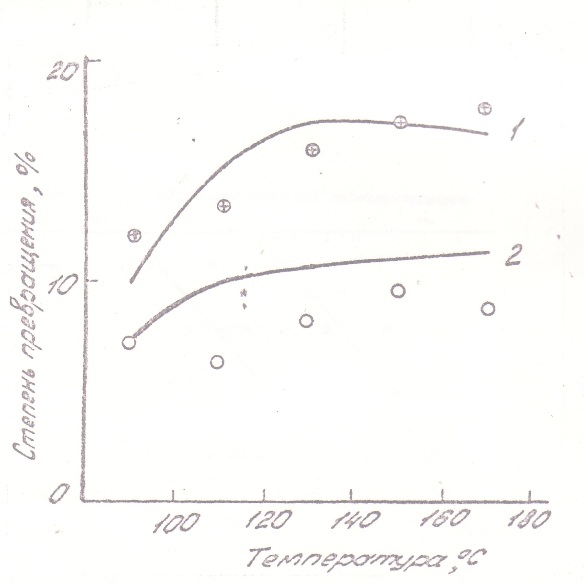
Вторая особенность процесса противоположна первой: за площадкой квазиравновесия реакция развивается лавинообразно, особенно в области более высоких температур и концентраций, поэтому температурная зависимость степени превращения за данное время может быть очень крутой (рис. 4).
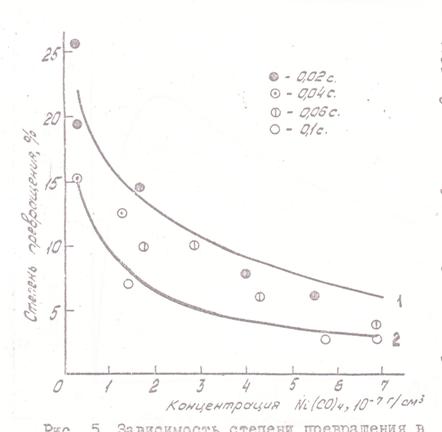
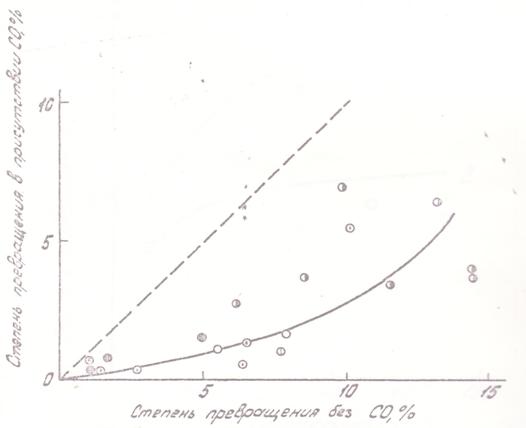
Зависимость степени превращения за данное время от концентрации КН выражена более слабо; при этом вследствие торможения продуктом увеличение концентрации КН вызывает снижение наблюдаемой степени превращения (рис. 5). Торможение продуктом было специально прослежено в опытах с введением в газ избытка СО; результаты показаны на рис. 6.
Снижение степени превращения под влиянием окиси углерода является естественным. В области низких температур, как видно из рис. 3, удается наблюдать изменение положения квазиравновесия (в сторону меньших степеней превращения) и увеличение продолжительности периода квазиравновесия. Это указывает на то, что присутствие продукта влияет прежде всего на гомогенную диссоциацию КН.
Приведенные выше данные относятся к условиям практического отсутствия влияния стенок. Они и были использованы при выборе параметров математической модели (см. ниже 4). Измерения в реакторах типа «а» и «б» (рис. 2) сопряжены с частичным осаждением аэрозоля на стенках, а при более высоких температурах - также и с заметной гетерогенной реакцией на стенках.
Подробный анализ конкуренции процессов в объеме и на стенке требует получения дополнительных данных и не входят в задачу настоящей работы. Заметим, однако, что вклад стенок может составлять около половины наблюдаемой степени разложения, что влияет и на протекание процесса в объеме. Поэтому в математическое описание процесса были введены члены для учета осаждения аэрозольных частиц и гетерогенной реакции на стенке. Это обеспечило удовлетворительное согласие опыта и расчета и для условий, где роль стенок была существенной. На рис.7 и 8 сопоставлены измеренные и рассчитанные степени превращения в объеме, причем расчет выполнен с учетом потерь на стенках реактора. Как видно из этих рисунков, и временная (при t = const) и температурная (при Т = const) зависимости степени превращения передаются моделью вполне удовлетворительно.
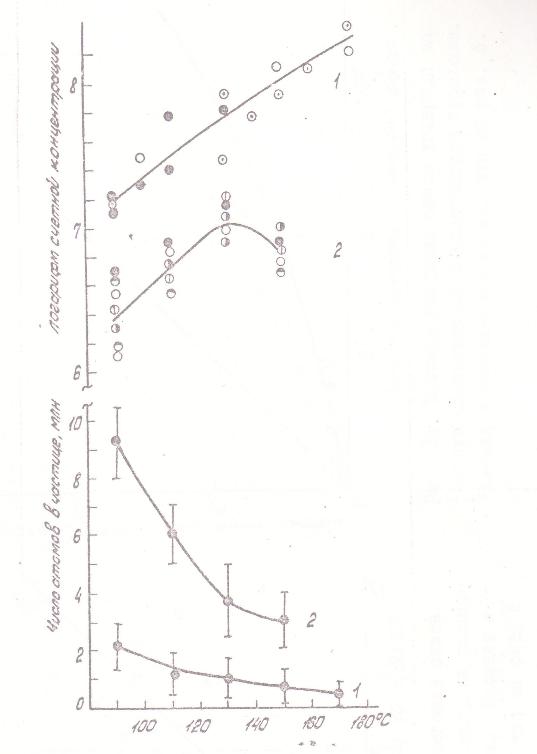
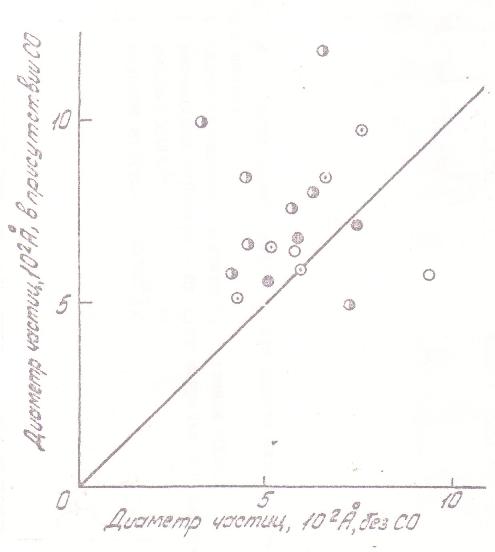
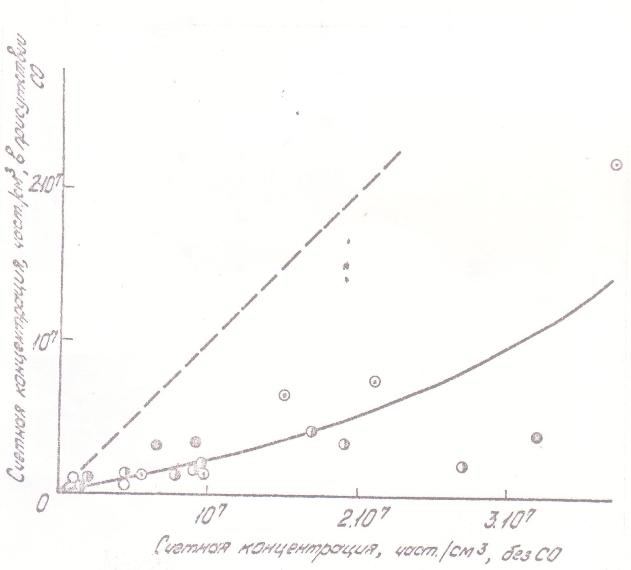
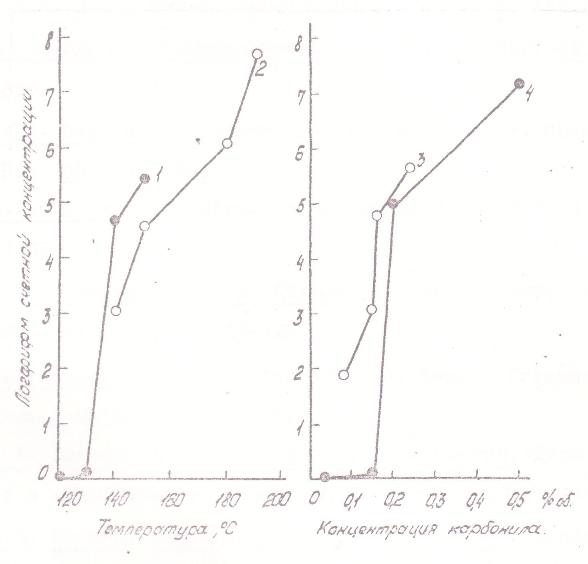
Другая часть полученных данных характеризует процессы роста частиц твердого никеля в зависимости от условий. На рис. 9 представлено изменение счетной концентрации и среднего размера частпц с увеличением концентрации карбонила и с ростом температуры, а на рис. 10 и 11 - уменьшение счетной концентрации и увеличение среднего размера частиц в присутствии СО. Эти зависимости слабее подвержены влиянию стенок и проявляются достаточно отчетливо. Качественно наблюдаемая картина отвечает представлениям теория конденсации: бóльшим «химическим пересыщениям», т.е. более высоким концентрациям карбонила и температурам отвечает меньший размер и бóльшая концентрация частиц. Смена этих зависимостей на противоположные при больших временах контакта должна быть приписана влиянию коагуляции, опережающей возникновение новых частиц аэрозоля.
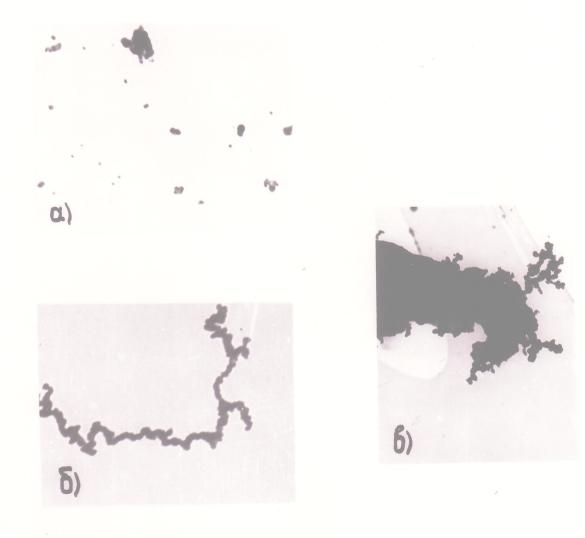
Коагуляционный рост частиц в изучаемом процессе, как выяснилось в ходе исследования, характеризуется необычными особенностями. На рис. 12 представлены электронно-микроскопические фотографии частиц никеля, свидетельствующие об образовании нитевидных агрегатов сферически частиц. Отсюда следуег, что начиная с некоторого размера частиц никеля их коагуляция становится направленной. (Впервые это было отмечено в работе [25]).
Механизм явления установлен Н.А.Фуксом: он заключается в сближении частиц под действием диффузии на такое расстояние, на котором силы притяжения «достигают заметной величины, после чего движение частиц приобретает упорядоченный характер» [26, стр. 282, 284]. В результате коагуляция протекает самоускоренно, и процесс роста частиц приобретает лавинообразный характер. Это явление было прослежено в опытах со сферическим реактором, из которого аэрозоль направляли непосредственно в ультрамикроскоп. При этом наблюдали именно более поздние стадии, относящиеся к направленной коагуляции. Полученные результаты (рис. 13) подтверждают заключение об ускоренном протекании коагуляции на этой стадии.
В табл. 3 приведены результаты определения размеров аэрозольных частиц электронно-микроскопическим методом. Эти размеры несколько ниже средних размеров, найденных по весовой и счетной концентрациям аэрозолей, возникших в аналогичных условиях. Следует, однако, иметь в виду, что числа табл. 3 относятся только к сферическим частицам, образование которых доказывается электронно-микроскопическими снимками. Поэтому данные двух методов не противоречат, а взаимно дополняют друг друга. Совокупность полученных экспериментальных данных была использована при математическом моделировании процесса.
4. МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ПРОЦЕССА
ТЕРМИЧЕСКОГО РАЗЛОЖЕНИЯ КАРБОНИЛА НИКЕЛЯ В ОБЪЕМЕ
В случае столь сложных объектов как рассматриваемый, математическое моделирование становится необходимым методом исследования, без применения которого анализ экспериментальных данных оказывается затруднительным, если вообще возможным.
Как упомянуто, ряд экспериментальных данных качественно согласуетоя с предсказаниями классической теории конденсации. Однако детальный анализ показал [9], что в действительности основная посылка классической теории - о существовании цепочки квазиравновесий между мономерами, докритическими и критическими частицами - не выполняется в большинстве случаев химической кристаллизации.
Применительно к рассматриваемому случаю для узкой области условий, где эта посылка могла бы быть выполнена, были проведены и машинные расчеты, которые подтвердили непригодность классического описания и необходимость микрокинетического подхода к процессу.
Математическая модель процессов химической кристаллизации в объеме, основанная на таком подходе, построена и подробно обсуждена в отдельной работе [12]. Записанная применительно к рассматриваемому случаю, модель учитывает гомогенную диссоциацию КН до одноядерных субкарбонильных осколков, агрегацию этих осколков в многоядерные субкарбонильные комплексы и, далее, в крупные частицы никеля (т.е. коагуляцию аэрозоля), а также обратимое гетерогенное разложение КН на частицах никеля.
Использование зтой модели предполагает знание характеристик этих стадий процесса. Кроме того, как упоминалось, необходим учет осаждения частиц и разложения КН на стенках. В машинных экспериментах варьировали параметры модели, подбирая их таким образом, чтобы достичь согласия между результатами расчетов и кинетических измерений. Ниже подробно рассматривается эта сторона работы.
Гомогенная диссоциация КН:
Ni (CO)4 = Ni (CO)3 + CO (I)
Cкорость гомогенной диссоциации КН представлена разностью скоростей прямой реакции (разложение КН) и обратной реакции (синтез КН):
Vv = K1nk - K2n1nc (1)
Здесь nk , nc и n1 - концентрации КН, СО и трикарбонила соответственно.
K1 - константа скорости прямой реакции, в соответствии с данными [27] о кинетике изотопного обмена КН с меченой СО, имеет величину
K1 = 3,3·1014·ехр (-22100/RТ) сек-1 ,
а константа скорости обратной реакции:
К2 = К1/К = 4,1·105Т л/моль·сек.
(Константа равновесия (1) К была определена ранее [8]).
(В предварительных машинных экспериментах испытывали также несколько других форм кинетического уравнения и его параметров, в том числе формулу вида
Vv = K1nk/ (1 + K*nc ) (2)
со значениями констант по данным различных авторов (см. табл. 1), а также принимали двухступенчатую диссоциацию тетракарбонила до дикарбонила с константами скорости второй ступени в прямом и обратном направлении соответственно
1014 · ехр (-30000/RT) сек-1 и 1,6.107 л/(моль·сек).
Ни в одном из вариантов, кроме основного, указанного вначале, не было получено результатов, сколько-нибудь приближающихся к экспериментальным данным).
Агрегация субкарбонилов:
Nig(CO)x + Nij(CO)y → Nig+j(CO)z + (x + y - z)CO (II)
g, j = 1, 2, 3, ...
Здесь z(g+j) - вероятное число групп CO в частице, содержащей (g+j) атомов никеля.
Эта стадия процесса экспериментально не исследована и единственное утверждение, вытекающее из опытных данных (масс-спектрометрия [28]), состоит в том, что такая стадия существует. Поэтому описание кинетики агрегации возможно только на основе более или менее правдоподобных предположений.
Исследованию в машинных экспериментах было подвергнуто три общих предположения, каждое из которых представлялось достаточно вероятным.
Согласно первому предположению агрегация является незатрудненной, т.е. не отличается от коагуляции (см. ниже). В пользу такого предположения можно выдвинуть следующие доводы. Реакция агрегации по характеру близка к реакциям рекомбинации радикалов и потому должна быть незатрудненной. Правда, исследования по конденсации паров выявили весьма низкую эффективность столкновений при образовании кластеров из 2-5 мономерных частиц [29]; это связано с трудностью отвода избыточной энергии, необходимого для стабилизации агрегата (стабилизация достигается тем легче, чем сложнее возникающая частица, так как тем вероятнее перераспределение энергии по внутренним степеням свободы). В нашем случае нет необходимости в стабилизации за счет тройных соударений, так как имеется другой канал для отвода избыточной энергии - отщепление карбонильной группы СО от возникшего агрегата. Поэтому предположение о незатрудненной агрегации априори представлялось вполне разумным.
Машинные эксперименты показали, однако, что при этом предположении невозможно передать наблюдаемый на опыте "индукционный" (квазиравновесный) период процесса, а время, необходимое для достижения экспериментальных степеней превращения, на порядок и даже на два меньше фактического. Поэтому гипотеза о незатрудненной агрегации была отвергнута.
Согласно второму предположению агрегацию рассматривали как затрудненный процесс с эффективностью соударений ß, растущей от малой величины ß2 для реакции между мономерными частицами до 1 для реакции образования агрегата из n* атомов; закон роста ß задавали в виде
log ß = log ß2(n* - g - j)/(n* -2) (3)
Таким образом, стадию агрегации характеризовали двумя параметрами: эффективностью столкновения мономерных частиц ß2 и шириной диапазона размеров частиц n*, в котором происходит переход от затрудненной агрегации к обычной коагуляции.
В этом случае оказалось возможным подобрать параметры агрегации, при которых качественно воспроизводится индукционный период процесса и рассчитанные общие скорости процесса близки к измеренным. Однако температурный ход скорости процесса при различных начальных концентрациях КН передать не удалось. Поэтому и вторая гипотеза о кинетике агрегации была отведена.
Наиболее удачным оказалось третье предположение о термически активируемой агрегации. Это предположение представляется более обоснованным и из общих соображений: агрегация двух субкарбонильных осколков есть по существу химическая реакция, и она требует активации, достаточной для удаления избыточных групп СО, препятствующих формированию связи металл-металл; с ростом размера агрегатов удаление СО облегчается и постепенно активационный барьер исчезает - агрегация переходит в обычную коагуляцию.
В уравнении для скорости агрегации
Va = Kag j CNig(CO)x CNij(CO)y (4)
(символами С обозначены концентрации агрегатов) константа скорости реакции Kag, j между частицами из g и j атомов никеля в соответствии с последней гипотезой имеет вид
Kag, j = K0g,j exp [-E(g+j)/RT] (5)
Для определения предэкспоненциального множителя K0g,j были проведены расчеты по уравнениям теории соударений и теории абсолютных скоростей реакций. Энтропию активированного комплекса при этом принимали равной энтропии агрегата Nig+j(CO)x+y . Анализ показал, что стерический множитель равен единице. Величина K0g,j , таким образом, может рассматриваться как коэффициент газокинетической коагуляции (см.ниже). Энергия активации реакции агрегации равна
E (g + j) = Ea · (n* - g ? j)/(n* - 2) (5)
n*³ g+ j ³2
Принятое линейное падение энергии активации с размером образующейся частицы является простейшим правдоподобным допущением. При значениях g + j > n* величина Е(g +j) принимается равной нулю и агрегация считается незатрудненной.
Таким образом, термически активируемую агрегацию характеризовали двумя параметрами, вполне аналогичными параметрам предыдущей гипотезы: энергией активации реакции между мономерными частицами Еа и шириной интервала размеров n*, в которой активированная агрегация постепенно становится неактивированной. Значения этих параметровварьировали в следующих диапазонах:
Eo - от 3 до 22 ккал: первое число отвечает нижнему пределу теплового эффекта реакции
Ni(CO)3 = Ni2(CO)5 + CO (III)
а второе - прочности связи Ni-СО в Ni2(CO)6;
n* - от 3 до 12 (нижнее значение отвечает активированной агрегации только мономеров, верхнее - всех частиц, для которых реакция вида (III), т.е. с отщеплением одной карбонильной группы, может быть эндотермичной.
По результатам машинных экспериментов была выбрана следующая наилучшая комбинация:
Еа = 9 ккал, n* =12.
Принятое значение Eo отвечает верхнему пределу теплового эффекта реакции (III).
Разумеется, описание кинетики агрегации, на котором мы остановились, нельзя считать доказанным, но оно, с одной стороны, является физически осмысленным, а с другой - не противоречит имеющимся экспериментальным данным.
Коагуляция
По мере роста частиц их агрегация перестает быть затрудненной и может рассматриваться как обычная газокинетическая коагуляция. Константа скорости такого процесса, или «коэффициент коагуляции» [30], в предположении о сферичности частиц и об их слиянии при столкновении, выражается известным соотношением кинетической теории газов:
Kgj = π (rg + rj)2 [(8kT/π).(mg + mj) / mgmj]1/2 (7)
где rg и rj - радиусы частиц, а mg + mj - их массы. В случае однокомпонентных частиц это соотношение переходит в более простое [31]:
Kgj = (9 π/16 ρNi)1/3 m11/6(kT)1/2 (g1/3 j1/3)2[(g+j)/gj]1/2 (8)
Здесь m1 - масса первичной частицы (атома никеля) а ρNi - плотность частиц, предполагаемая не зависящей от их размера.
В случае частиц Nig(CO)x и Nij(CO)y такое упрощение, особенно при небольших g и j, вызывает завышение вычисляемой величины Kgj. Легко, однако убелиться, что эта ошибка незначительна: так для частиц, содержащих 100 атомов никеля (состав Ni100(CO)63, см. ниже), Kgj завышается на 10% и даже при g=10 ошибка не превосходит 25%.
С другой стороны, поправка к значению Kgj, учитывающая влияние молекулярных сил на эффективное сечение столкновений, представляет собой множитель, равный 2-3 [1З, 30]. Исходя из этих, соображений величину коэффициента коагуляции приняли равной 2 Kgj , где Kgj задана формулой (8). Этот выбор представляется логичным и первоначально в расчетах использовали именно такие величины коэффициентов коагуляции.
Однако результаты предварительных вычислений показали, что на опыте наблюдаются гораздо большие размеры частиц, чем дает расчет, а счетная концентрация на несколько порядков ниже вычисленной. Это расхождение заставило обратить внимание на то, что формула (8) пригодна лишь для таких частиц никеля, магнитное взаимодействие между которыми пренебрежимо мало.
Расчет множителя ßM , на который увеличивается газокинетическая константа коагуляции вследствие диполь-дипольного взаимодействия между частицами, выполнен в работе Цебеля [32]; окончательный результат имеет вид
ßM = 1/Ro2 (mg mj /kT)2/3 (9)
где Ro - сумма газокинетических радиусов, а mg и mj -дипольные моменты частиц. Для ферромагнитного никеля mg = 0,604 Ω mB g, где mB - магнетон Бора, 0,927.10-20 эрг/эрст, а Ω - отношение намагниченности насыщения при температурах Т°К и 0°К.
Учитывая, что для простейшего случая одинаковых g-атомных частиц (1/2). Ro = 1.41.10-8.g1/3 см, находим, что при Т = 600°К ßM = 2,3.10-4.g 2/3 . Отсюда, положив ßM = 1, получаем минимальный размер частиц, go , начиная с которого коагуляция становится направленной: go = 3.105 . Легко убедиться, что в случае неодинаковых частиц условие ßM > Iможет быть выполнено лишь, если наименьшая из частиц имеет размер g ³ go .
Результаты этих оценок были сопоставлены с данными электронно-микроскопических исследований нитевидных агрегатов малых частиц никеля. Измерения минимальных диаметров частиц в таких агрегатах, возникших при 600 °К (выполненные на фотоснимках с общим увеличением 50-60 тыс.), показали, что агрегация становится направленной при диаметре частиц 230-240 Å , т.е. g> 5.105 атомов. Это хорошо согласуется с приведенными выше результатами расчета по уравнению (9), особенно если учесть, что расчетное значение go = 3.105 есть нижняя граница, начиная с которой фактор ßM становится больше 1. Подставляя экспериментальную величину g= 5.105 в (9), получаем разумный результат ßM = 6,2. Для частиц, возникших при 150оС (423оК) опыт дал g > 1,5.105, откуда ßM = 2.
Таким образом, для учета магнитных взаимодействий при коагуляции можно использовать соотношение (9). После подстановки в (9) значений входящих в него параметров, в том числе температурной зависимости намагниченности насыщения никеля, получаем простую расчетную формулу
ßM = (688 - T).10-5. (gj)2/3/ (g1/3+j1/3)2 (10)
Разумеется, следует отдавать себе отчет в том, что при учете магнитных взаимодействий описание коагуляции остается приближенным, поскольку крупные частицы не успевают сливаться между соударениями и приобретают вытянутую форму; в результате газокинетическая формула становится неточной. Тем не менее, именно введение фактора ßM позволило устранить возникшее вначале резкое расхождение расчета и эксперимента.
Осаждение частиц на стенках реактора
учитывали введением добавочного члена во всех уравнениях для изменения концентраций частиц. Ввиду турбулентного характера движения потока в реакторе скорость осаждения выражали соотношением [23, стр.240] :
J = αD3/4ngRe7/8n 1/4/57r част/см2·сек (11)
Здесь D - коэффициент диффузии g-атомных частиц; ng - их концентрация в объеме; r - радиус канала; n - кинематическая вязкость газа; α - множитель порядка единицы. Учитывая, что критерий Рейнольдса Re = 2wr/n (w - линейная скорость потока), и выражая D и n подходящими интерполяционными формулами, получили расчетное соотношение, в котором поток на стенку отнесен к единице объема реактора (цилиндрического):
Vocg = w7/8 ng /T 7/16 r 9/8 g 3/8 част/сек.см3 (12)
Гетерогенная реакция на частицах и на стенках.
Кинетика гетерогенной реакции на поверхности компактного никеля определяется уравнением
V∞ = K3pk(10-6 + pk) · (1 - pc4/Kppk)/(0,01+K4pc+K5pk)2 (13)
Уравнение (13) уточнено по сравнению с ранее опубликованным [34] для очень малых содержаний КН в газе. Индекс ∞ указывает на то, что значение скорости относится к компактномуникелю; рk и рc обозначают парциальное давление КН и СО соответственно; второй сомножитель в числителе учитывает обратимость реакции, значения кинетических констант равны:
K3 = 4,32.1013 exp (-22300/RT) г/см2.мин.атм2;
К4 = 8,21.10-4 ехр( 10300/RТ) атм-1;
Ко - 7,70.104 ехр(- 5000/RT) атм-1;
Kp - константа равновесия - равна Кp = ехр(100,2Т - 34000)/RТ).
Способ учета изменения скорости при переходе от плоской поверхности никеля к малым (g -атомным) частицам, обладающим избыточной энергией Ug, рассмотрен ранее [9, 34]:
Vg =Vпр exp(-Ug/2RT) - Vобр exp (Ug/2RT) (14)
Здесь Vпр и Vобр обозначают скорости прямой и обратной гетерогенной реакции на компактном никеле.
Аналогично записывается скорость гетерогенной реакции на стенке: по экспериментальным данным [34]
Vст = V∞ exp [-60000/(n + 12)RT] (15)
Здесь n - число атомных слоев никеля на стенке.
Характеристика частиц.
В процессе участвуют разнообразные частицы общей формулы
Nig(CO)x , при малых g представляющие собой субкарбонильные комплексы, а при больших g - частицы никеля с хемосорбированной на их поверхности окисью углерода. В принятом приближении x - число групп СО - определяется только числом атомов никеля в частице g и не имеет самостоятельного значения. Однако знание количества связанной с никелем окиси углерода необходимо для определения, из условия материального баланса, концентрации СО в газовой фазе. Исходя из термодинамических характеристик частиц [35, 36] и из геометрических соображений была принята следующая зависимость числа групп СО в частице от g:
z(g) = 1,11 + 1,89g при g < 10
z(g) = 14,35 + 0,565g при 75 > g ³ 10 (16)
z(g) = gs при g ³ 75
Здесь gs есть число поверхностных атомов в кластере Nig.
Для определения gs в функции от общего числа атомов g в кластере из металлических шариков строили модели сферической формы с неупорядоченной упаковкой (для этого шарики покрывали липким составом) с числом шариков в модели от 14 до 100. Хотя результаты этих опытов показали некоторую немонотонность зависимости gs от g, для целей настоящей работы можно было удовлетвориться следующей аппроксимацией:
gs = g [1 - 0,0033(g -1)] при g < 75
gs = 3,2g2/3 при g ³ 75 (17)
Через число поверхностных атомов выражали и поверхность частиц, предоставляемую для гетерогенной реакции; она равна 0,78.10-15 gs см2; числовой множитель отвечает площади, приходящейся на один поверхностный атом никеля.
Избыточная энергия кластеров Nig (на 1 грамм-атом никеля), входящая в уравнение (14), дается простой формулой [36]
Ug = 85000g-1/3 ккал/г-атом (18)
Наконец, коэффициент диффузии частиц, необходимый для определения скорости их осаждения на стенках аппаратуры, представили простой интерполяционной формулой
Dg = (0,793/g1/2).(T/293)3/2 см2/сек (19),
которая построена по значениям, предложенным Н. А. Фуксом [37]. Для g=1 использовали значение 0,07 см2/сек (коэффициент диффузии карбонила никеля в СО при 20о).
Пригодность построенной математической модели и выбранных значений ее параметров иллюстрируется приведенными выше рисунками, в особенности данными рис. 3.
Хотя полного совпадения расчетных и измеренных величин протяженности и высоты площадок квазиравновесия добиться не удалось, учитывая с одной стороны сложность и неустойчивость процесса и с другой - неизбежные погрешности измерений и вычислений, следует признать, что согласие между результатами эксперимениального исследования процесса и его математическим описанием является вполне удовлетворительным. Достаточно хорошо модель учитывает и осложнения, связанные с влиянием стенок (рис. 5, 7, 8).
5. ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Последний из опубликованных обзоров, посвященных кинетике разложения карбонила никеля заканчивается выводом: «не найдено логической последовательности стадий, которая давала бы наблюдаемый суммарный процесс» [38]. Действительно, традиционное кинетическое описание процесса химической кристаллизации в объеме оказывается невозможным: оно недостаточно для учета практически бесконечного числа стадий, слагающих такие процессы.
Результаты измерений и расчетов показывают, что для суммарного процесса разложения КН в объеме определение обычных кинетических характеристик - энергии активации и порядков реакции - лишено смысла, т.к. даже сравнение скоростей процесса при равных степенях превращения (что является наиболее строгим) в зависимости от выбранного диапазона условий дает различные значения кинетических характеристик; это обусловлено изменениями соотношения вкладов разных стадий при изменении условий. В частности, наблюдаемая энергия активации процесса может принимать значения от 5 до 60 ккал/моль. С этим, очевидно, и связаны резкие расхождения в результатах различных авторов.
С другой стороны, полученные данные несовместимы и с распространенным представлением об образовании частиц металлического никеля в результате физической конденсации атомного пара никеля, который первоначально возникает за счет полного разложения КН.
Более того, оказалось, что протекание процесса не может быть описано и с помощью представлений классической теории конденсации, модифицированной применительно к обратимым химическим реакциям [9]. Даже когда качественная картина согласуется с этими представлениями, как, например, в случае введения в газ окиси углерода, механизм наблюдаемых изменений заключается не в увеличении размера критических зародышей при снижении пересыщения, а в действии кинетических факторов. Именно увеличение среднего размера частиц в присутствии окиси углерода являются естественным следствием торможения продуктом начальных стадий разложения: замедление образования субкарбонильных осколков в конце концов приводит к тому, что и коагуляция малых частиц и гетерогенное разложение остающегося КН происходят на сравнительно небольшом числе первоначально возникших крупных частиц. Такой ход процесса наглядно прослеживается в машинных экспериментах [12].
Удовлетворительное описание химической кристаллизации никеля при термическом разложении КН достигнуто на основе микрокинетического подхода, который учитывает следующие стадии процесса:
(I) гомогенную диссоциацию Ni(CO)4 до Ni(CO)3 + CO;
(II) активированную агрегацию субкарбонильных осколков с образованием первичных частиц никеля:
(III) коагуляцию аэрозоля никеля;
(IV) гетерогенное разложение карбонила на частицах никеля со скоростью, зависящей от их размера.
Основания для выбора значений параметров отдельных стадий, установленных в настоящей работе, приведены выше. Хотя нельзя исключать возможности описания процесса и другим набором параметров (в особенности это относится к кинетике агрегации, для которой прямые измерения отсутствуют), все же принятые значения кинетических параметров стадий представляются весьма вероятными.
Дальнейшее исследование рассматриваемого процесса (и подобных ему процессов химической кристаллизации в объеме) требует специальных прямых измерений свойств и реакций кластеров, в нашем случае - многоядерных субкарбонилов никеля.
Последний вопрос, на котором необходимо остановиться, относится к возможности использования результатов настоящего исследования в технологии производства дисперсного карбонильного никеля.
Прежде всего, полученные экспериментальные данные непосредственно указывают условия получения никеля в наиболее высокодисперсном состоянии, которое доступно для карбонильных металлов. Как явствует из чисел табл.2 (п.п. 40 и след.), применяя описанную в работе технику генерации и закалки высокодисперсных частиц, возможно получить никель дисперсностью в 10-15Å .
Улавливая эти частицы органическими жидкостями, получали ферромагнитные суспензии для коллоидно-химических исследований, могущие найти и прикладные применения.
Далее, полученные данные позволили выяснить основные этапы формирования частиц карбонильных никелевых порошков; в условиях технологического процесса эти этапы протекают столь быстро, что наблюдению не поддаются. Отсюда, в свою очередь, вытекают некоторые следствия относительно способов воздействия на технологический процесс.
Именно, переход к промышленному аппарату требует учета прежде всего двух осложнений - замедленности смешения поступающего пара с горячим содержимым аппарата и присутствие в газе с самого начала разложения свежей порции карбонила, ранее возникших частиц никеля. Исследование этих вопросов на основе разработанной математической модели и установленных выше ее параметров - предмет самостоятельной работы; однако качественные выводы о возможности регулирования процесса изменением условий смешения и циркуляции газовзвеси в аппарате очевидны непосредственно.
Весьма важным технологическим показателем является "качество" порошка карбонильного никеля, характеризуемое его насыпным весом и определяемое характером агрегации первичных частиц никеля.
Выше было видно, что особенностью дисперсного состава продуктов разложения КН в объеме является присутствие во всех исследованных образцах как малых равноосных, практически сферических частичек, так и их агрегатов нарастающих размера и сложности формы (см. рис. 12). Естественное объяснение этого основывается на рассмотрении относительных скоростей коагуляции и спекания частиц. Коагуляция порождает частицы сферической формы постольку, поскольку время между столкновениями двух частиц больше, чем время, необходимое для полного слияния (спекания) этих частиц; если же коагуляция опережает спекание, то она будет давать не сферические частицы, а их агрегаты сложной формы.
С увеличением размера частиц при их коагуляционном росте время, необходимое для полного слияния частиц (τ спек ) растет быстрее, чем время между столкновениями (τ коаг). Поэтому, начиная с некоторого критического размера, определяемого условием τ спек = τ коаг , характер коагуляции должен измениться: произойдет переход от увеличения размера сферических частиц к образованию их агрегатов.
Учет этих особенностей формирования частиц порошков в технологическом аппарате открывает возможность воздействия на качество порошков путем изменения условий коагуляции аэрозоля (в частности, наложением магнитных полей, действием ультразвука, а также изменением гидродинамической обстановки в аппарате).
Наконец, возможны чисто химические воздействия на технологический процесс, включающие введение активирующих добавок. Предлагаемая схема позволяет рассматривать влияние на процесс активирующих добавок (кислород, сероводород), которые описаны в патентной литературе,одним из двух способов:
б) добавка ускоряет гетерогенную реакцию на частицах. (Разумеется, возможно, что происходит и то и другое). В обоих случаях должно происходить как увеличение размера частиц, так и повышение степени превращения за данное время.
Таким образом, результаты проведенного физико-химического исследования дают лучшее понимание сущности уже известных технологических приемов и, позволяют наметить и новые технологические варианты.
Главным результатом работы является установление общей картины процесса «химической кристаллизации» никеля при термическом разложении карбонила никеля в объеме. Схема процесса включает в себя следующие влияющие друг на друга стадии: гомогенную диссоциацию КН до трикарбонила, активированную агрегацию субкарбонильных осколков, газокинетическую коагуляцию, направленную коагуляцию ферромагнитных частиц никеля, гетерогенное разложение карбонила на частицах никеля.
Математическая модель процесса, учитывающая перечисленные стадии, позволила удовлетворительно описать наблюдаемые особенности процесса, в частности, существование периодов квазиравновесия и лавинного протекания после образования достаточно большого количества аэрозольных частиц,
Можно предполагать, что сходные механизм и способ описания имеют силу и для других процессов химической кристаллизации в объеме.
Авторы приносят глубокую благодарность Н.А.Фуксу и А.Г.Сутугину за помощь в постановке этой работы, а также М.А. Немойтину за электронно-микроскопические съемки образцов.
|
Данные о кинетике термического разложения КН в объеме |
||||||
|
Автор и год публикации |
Поверхность реактора |
Температура,°C |
Давление, атм |
Концентрация, % |
Энергия активации, ккал/моль |
Кинетическое уравнение |
|
Гаррат и Томсон, 1934 [1] |
стекло |
70-100 |
0,04-0,08 |
100 |
12,0 |
(2)4) |
|
Баун, 1935[2] |
- |
100-128 |
0,02-0,08 |
100 и ниже |
10,2 |
(2)4) |
|
Чен и Макинтош, 1962 [3] |
стекло никель |
35-80 |
0,02-0,1 |
100 и ниже |
19,1 |
(2)1)4) |
|
Дей, Басоло и Пирсон, 1963 [4] |
тонкий слой никеля на стекле |
47-66 |
1 |
0,04 |
44,7±3
|
(2)4) |
|
Цылов, 1971 [5] |
- |
100-400 |
1 |
12) |
8,32) |
- |
|
Белозерский и Сегаль, 1972 [6] |
стекло |
60-170 |
1 |
100 и ниже |
21,63) |
- |
|
Гузен и Ванденберг, 1972 [7] |
никелированное стекло |
50-90 |
0,25 |
100 |
17,2 |
(2)1)4) |
|
1) Постулировано авторами 2) Вычислено по экспериментальным данным оригинала 3) Для первого порядка реакции |
||||||
|
4) Кинетическое уравнение (2): Vv = K1nk/ (1 + K*nc ) |
||||||
|
Характерные условия и результаты разложения КН в потоке с измерением весовой и счетной концентрации аэрозолей никеля |
||||||||||||
|
Номер опыта |
Потоки на реактор, л/мин |
Условия в реакторе |
Характеристики аэрозоля |
Степень превращения КН в объеме, % |
||||||||
|
Парогазовая смесь с КН |
Горячий азот |
Разбавление на выходе |
Время пребывания, сек |
Температура,°C |
Начальная концентрация КН 10-7 г/см3 |
Весовая концентрация, 10-9 г/см3 |
Счетная концентрация, 107 част/см3 |
Среднее число атомов в частице, млн. |
||||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
||
|
1 |
0,08 |
1,1 |
- |
1,9 |
100 |
0,5 |
0,86 |
0,95 |
0,9 |
5,2 |
||
|
2 |
" |
" |
- |
" |
115 |
" |
1,95 |
1,6 |
1,2 |
11,3 |
||
|
3 |
" |
" |
- |
" |
125 |
" |
1,73 |
2,0 |
0,86 |
10,0 |
||
|
4 |
" |
" |
- |
" |
130 |
" |
2,25 |
3,5 |
0,64 |
13,1 |
||
|
5 |
" |
" |
- |
" |
135 |
" |
4,4 |
3,1 |
1,4 |
25 |
||
|
6 |
" |
" |
- |
" |
140 |
" |
9,15 |
1,0 |
9,1 |
53 |
||
|
7 |
" |
" |
- |
" |
145 |
" |
17,5 |
0,62 |
28,0 |
100 |
||
|
8 |
0,15 |
5,85 |
6 |
0,02 |
90 |
3,4 |
8,7 |
3,8 |
2,3 |
7,4 |
||
|
9 |
0,10 |
3,90 |
" |
0,03 |
" |
" |
11,1 |
1,85 |
6,0 |
9,5 |
||
|
10 |
0,10 |
3,90 |
" |
0,03 |
" |
" |
8,6 |
3,2 |
2,7 |
7,3 |
||
|
11 |
0,052 |
2,05 |
4 |
0,06 |
" |
" |
6,5 |
0,81 |
8,0 |
5,55 |
||
|
12 |
0,052 |
2,05 |
4 |
0,06 |
" |
" |
9,4 |
0,55 |
17 |
8,0 |
||
|
13 |
0,03 |
1,17 |
3 |
0,1 |
" |
" |
6,6 |
0,42 |
15,5 |
5,6 |
||
|
14 |
0,03 |
1,17 |
3 |
0,1 |
" |
" |
4,5 |
0,125 |
36 |
3,85 |
||
|
15 |
0,04 |
3,0 |
3 |
0,02 |
" |
0,28 |
1,88 |
1,0 |
1,9 |
19,5 |
||
|
16 |
0,03 |
3,0 |
3 |
0,02 |
" |
0,21 |
1,75 |
1,4 |
1,25 |
24,1 |
||
|
17 |
0,04 |
1,46 |
2 |
0,04 |
" |
0,28 |
1,5 |
0,95 |
1,6 |
15,5 |
||
|
18 |
0,05 |
2,95 |
3 |
0,02 |
" |
1,5 |
7,65 |
1,6 |
4,8 |
14,8 |
||
|
19 |
0,08 |
1,5 |
2 |
0,04 |
" |
1,2 |
5,2 |
1,15 |
4,5 |
12,5 |
||
|
20 |
0,03 |
0,97 |
2 |
0,06 |
" |
1,6 |
5,5 |
0,51 |
11 |
10 |
||
|
21 |
0,02 |
0,60 |
2 |
0,1 |
" |
1,3 |
3,1 |
0,16 |
19 |
7,0 |
||
|
22 |
0,045 |
1,0 |
2 |
0,06 |
" |
2,7 |
9,2 |
0,23 |
40 |
9,9 |
||
|
23 |
0,055 |
1,0 |
2 |
0,06 |
" |
3,2 |
4,4 |
0,275 |
16 |
4,0 |
||
|
24 |
0,100 |
2,9 |
3 |
0,02 |
" |
4,0 |
10,2 |
0,57 |
18 |
7,4 |
||
|
25 |
0,06 |
1,95 |
2 |
0,06 |
" |
4,2 |
10,7 |
0,30 |
35 |
6,0 |
||
|
26 |
0,12 |
2,88 |
3 |
0,02 |
" |
5,3 |
11,5 |
0,34 |
34 |
6,25 |
||
|
27 |
0,04 |
1,16 |
2 |
0,1 |
" |
5,6 |
5,1 |
0,085 |
60 |
2,65 |
||
|
28 |
0,08 |
1,95 |
2 |
0,06 |
" |
7,1 |
9,5 |
0,30 |
32 |
3,9 |
||
|
29 |
0,05 |
1,15 |
2 |
0,1 |
" |
7,1 |
5,4 |
0,26 |
21 |
2,2 |
||
|
30 |
0,04 |
1,15 |
2 |
0,1 |
90 |
1,65 |
4,15 |
0,48 |
8,6 |
7,3 |
||
|
31 |
" |
" |
" |
" |
110 |
" |
3,65 |
0,60 |
6,1 |
6,4 |
||
|
32 |
" |
" |
" |
" |
130 |
" |
4,8 |
1,3 |
3,7 |
8,4 |
||
|
33 |
" |
" |
" |
" |
150 |
" |
5,5 |
0,75 |
7,3 |
9,7 |
||
|
34 |
" |
" |
" |
" |
170 |
" |
5,2 |
0,86 |
6,05 |
9,15 |
||
|
35 |
0,05 |
2,05 |
2,5 |
0,06 |
90 |
" |
7,0 |
0,36 |
19,5 |
12,2 |
||
|
36 |
" |
" |
" |
" |
110 |
" |
7,7 |
0,50 |
15 |
13,5 |
||
|
37 |
" |
" |
" |
" |
130 |
" |
9,1 |
0,75 |
12 |
16 |
||
|
38 |
" |
" |
" |
" |
150 |
" |
9,9 |
0,68 |
14 |
17,4 |
||
|
39 |
" |
" |
" |
" |
170 |
" |
10,2 |
0,82 |
12,5 |
17,9 |
||
|
40 |
0,02 |
2,16 |
4,6 |
0,1 |
110 |
6,7*10-5 |
1,2*10-3 |
15,5 |
7·10-5 |
52 |
||
|
41 |
" |
" |
" |
" |
" |
6,7·10-5 |
0,8·10-3 |
4,1 |
2·10-4 |
35 |
||
|
42 |
" |
" |
" |
" |
" |
6·10-4 |
1,7·10-3 |
21 |
8·10-5 |
8 |
||
|
43 |
" |
" |
" |
" |
" |
6·10-4 |
1,1·10-3 |
7,0 |
1,5·10-4 |
5,3 |
||
|
44 |
" |
" |
" |
" |
" |
5,6·10-3 |
1,0·10-3 |
2,0 |
5·10-4 |
0,52 |
||
|
45 |
" |
" |
" |
" |
" |
5,6·10-3 |
2,3·10-3 |
1,8 |
1,3·10-3 |
1,2 |
||
|
46 |
" |
" |
" |
" |
" |
0,053 |
4,2·10-3 |
1,55 |
2,8·10-3 |
0,2 |
||
|
47 |
" |
" |
" |
" |
" |
0,053 |
1,3·10-2 |
1,35 |
1·10-2 |
0,7 |
||
|
48 |
" |
" |
" |
" |
" |
0,57 |
0,047 |
0,78 |
6,2·10-2 |
0,24 |
||
|
49 |
" |
" |
" |
" |
" |
0,57 |
0,152 |
9,1 |
1,7·10-2 |
0,77 |
||
|
Номера опытов |
Тип реактора |
Объем камеры, см3 |
||||||||||
|
1-7 |
Тройниковый |
38 |
||||||||||
|
8-14; 25; 27-39 |
Рис. 2б |
1,96 |
||||||||||
|
15-24; 26 |
Рис. 2б |
0,98 |
||||||||||
|
40-49 |
Рис. 2а |
3,6 |
||||||||||
|
Размеры частиц никеля, полученных при разложении разбавленных паров КН в лабораторных реакторах |
|||
|
Условия разложения |
Преобладающие размеры сферических частиц, Å |
||
|
Температура,°C |
Концентрация КН на входе в реактор, г/см3 |
Время пребывания в реакторе, сек |
|
|
180 |
2·10-7 |
0,06 |
50-100 |
|
180 |
2·10-7 |
0,2 |
50-100 |
|
150 |
5·10-8 |
0,06 |
50-100 |
|
150 |
2·10-7 |
0,06 |
50-100 |
|
150 |
5·10-6 |
0,06 |
100-200 |
|
150 |
5·10-5 |
0,06 |
300-500 |
|
90 |
5·10-6 |
0,06 |
100-200 |
|
90 |
5·10-6 |
0,2 |
100-200 |
|
270 |
1,4·10-4 |
1,5 |
150-200*) |
|
200 |
1,4·10-4 |
1,6 |
50-100*) |
|
150 |
1,4·10-4 |
1,5 |
50-100*) |
|
*) По данным исследования диспергированного порошкообразного продукта, собранного на выходе из реактора |
|||
|
Рис. 1 Общая схема установки для измерения кинетики разложения карбонила никеля в объеме и среднего размера образующихся аэрозольных частиц
|
|
|
1 |
- подача газа-носителя (азот или СО), |
|
2 |
- подача азота, |
|
3 |
- контейнер-насытитель с КН, |
|
4 |
- нагреватель азота, |
|
5 |
- реактор (со смесителем на входе и закалочной камерой на выходе), |
|
6 |
- фильтры Петрянова, |
|
7, 8 |
- неселективные "разбавители" аэрозоля, |
|
9,10 |
- приборы КУСТ, |
|
11 |
- ультрамикроскоп |
|
12 |
- нефелометр |
|
Рис. 2. Схемы проточных реакторов для исследования кинетики разложения КН в объеме: а) металлический реактор с радиально-щелевым смесителем и закалочной камерой: 1 - реакционный объем, 2 - вход в закалочную камеру, 3 - радиально-щелевой смеситель. б) стеклянный реактор со щелевым смесителем и закалочной камерой; в) металлический реактор с радиально-щелевым смесителем и переменным реакционным объемом. |
|
Рис. 3. Кинетика термического разложения КН в объеме: Точки - эксперимент (измерения в реакторе Рис. 2. в) ), сплошные линии - расчет. Температура измерений: 1,6 - 53°C; 2, 8, 9, 10 - 70°C; 4 - 75°C; 3, 5, 7 - 84°C. Начальная концентрация КН: 1, 2, 3, 4, 5, 9 - 1,08·10-7 г/см3; 6,7 - 2,83·10-7 г/см3; 8 - 2,8·10-8 г/см3; 10 - 7,1·10-7 г/см3. Отношение молярных концентраций КН/СО: 4, 5 - 1/0,5; остальное 1/0,1. |
|
Рис. 4. Температурная зависимость степени превращения |
|||
|
Номер Кривой |
Условия измерений |
||
|
|
Концентрация КН на входе в реактор, г/см3 |
Концентрация СО, г/см3 |
Время пребывания в реакторе, Сек |
|
1 |
1,08·10-7 |
1,8·10-9 |
1,6 |
|
2 |
5,0·10-8 |
0,9·10-9 |
2,0 |
|
3 |
4,0·10-5 |
1,3·10-3 |
5,0 |
|
4 |
1,5·10-7 |
6·10-7 |
0,06 |
|
Рис. 5. Зависимость степени превращения в объеме (при влиянии осаждения на стенках) от начальной концентрации КН при 90°C и различном времени пребывания. Сплошные линии - расчет для времени пребывания: 1 - 0,02 сек, 2 - 0,10 сек |
|
Рис. 6. Изменение степени превращения в присутствии окиси углерода (CO: КН = 300:1) |
||
|
Обозначение точек |
Температура, °C |
Концентрация КН, г/см3 |
|
|
60-90 |
(2 - 4)·10-6 |
|
|
110-150 |
(2 - 4)·10-6 |
|
|
60-90 |
1,5·10-7 |
|
|
110-150 |
1,5·10-7 |
|
Пунктир отвечает отсутствию влияния CO |
||
|
Рис. 7. Изменение степени превращения в объеме с ростом времени пребывания в реакторе (при влиянии осаждения частиц на стенках). Точки - эксперимент, сплошная линия - расчет. Условия измерений: Температура 90°C; концентрация КН 3,4·10-7 г/см3; объем реакционной камеры 1,96 см3 |
|
Рис. 8. Изменение степени превращения в объеме с температурой (при влиянии осаждения частиц на стенках). Точки - эксперимент, сплошная линия - расчет. Условия измерений: концентрация КН 1,6·10-7 г/см3; Время пребывания в реакторе: 1-0,06 сек, 2-0,10 сек. |
|
Рис. 9. Влияние температуры на счетную концентрацию и размер частиц никеля: 1 - начальная концентрация КН 2·10-8 г/см3, время реакции 0,02 сек; 2 - начальная концентрация КН 1,5·10-7 г/см3, время реакции 0,06 сек. Различные обозначения точек относятся к различным сериям измерений. |
|
Рис. 10. Влияние введения окиси углерода в газовую фазу на размер образующихся частиц. Условия и обозначения те же, что на Рис 6. |
|
Рис 11. Влияние введения окиси углерода на счетную концентрацию образующегося аэрозоля. Условия и обозначения те же, что на рис 6. |
|
Рис. 12. Электронно-микроскопические снимки аэрозольных частиц никеля: а) малые равноосные частицы (увеличение 60 000); б) нитевидные агрегаты - продукт направленной коагуляции (увеличение 30 000) в) крупные агрегаты (увеличение 10 000) |
|
Рис. 13. Зависимость счетной концентрации частиц никеля ультрамикроскопического размера от условий: 1,2 - начальная концентрация КН 0,14 и 0,05 % об.; время пребывания соответственно 10 и 15 сек; 3,4 - температура разложения 140 и 120 °C, время пребывания 15 сек |
1. А.Р. Gаггаt, Н. W. Тоmрsоn, J. Сhеm. Soc., 1934, 1822-1825.
2. C. E. H. Bawn, Тгаns. Fаrаdау Sоc., 1935, 31, 440-446.
3. R. K. Chan, R. McIntosh, Canadian J. Chem., 1962, 40, 845-855.
4. J. Ph. Day, R. G. Pearson, F. Basolo, J. Amer. Chem. Soc., 1968, 90, 6933-6938.
5. Б.А. Цылов, Порошковая металлургия, 1971, № 5 (101), 21-26.
6. Н. А. Белозерский, Л. Д. Сегаль, Тр. инст. Гипроникель, 1972, вып. 53, с. 118-127.
7. А. J. Goosen, J. A. Van den Berg, J. South African Chem. Inst., 1972, 25; 370-380.
8. А.Я. Кипнис, Л.А. Померанцева, А.Е. Рюмшин,. Депонировано в ОНИИЕЭХИМ, г. Черкассы, 1978 г., 2149/78 Деп.
9. А.Я. Кипнис, Л.А. Померанцева, А.Е. Рюмшин,. Депонировано в ОНИИЕЭХИМ, г. Черкассы, 1978 г., 2147/78 Деп.
10. А. Е Рюмшин, А. Я. Кипнис, П. А. Кулле, С6. "Математическое моделирование в науке к технике", Издательство ЛТИ им. Ленсовета, вып. 2, ч. 2, Л., 1974
11. А. Е Рюмшин, А. Я. Кипнис, П. А. Кулле, С6. "Математическое моделирование в науке к технике", Издательство ЛТИ им. Ленсовета, вып. 2, ч. 4, Л., 1975
12. А.Е. Рюмшин, А.Я. Кипнис, Депонировано в ВИНИТИ, 1979 г.
13. Н. А. Фукс, А. Г. Сутугин, Коллоидный журнал, 1966, 28, № 1, 131-138.
14. А.А. Мазловский, Коллоидный журнал, 1970, 32, № 2, 238-244.
15. А. А. Мазловский, Канд. дисс, АН Латв. ССР, ОХН, Рига, 1971.
16. И. В. Петрянов и др., Волокнистые фильтрующие материалы ФП, "Знание", М., 1968.
17. А. Г. Сутугин, Измерительная техника, 1971, № 8, 79-80.
18. Я. И. Коган, З.А. Бурнашева, Ж. физ. химии, 1960, №12, 34, 2630-2639.
19. Е. А. Вигдорчик ЛенНИИ Гигиены труда и профзаболеваний, Л. 1948, с. 131-177.
20. Е. Т. Лыхина, С. С. Саркисова, ГосНИИ Гигиены труда и профзаболеваний, Тр. научной сессии (1956), Л., 1958, с. 182-186.
21. Я. И. Коган, Заводская лаборатория, 1958, 24, №2, 215-219.
22. А. Я. Кипнис, Н.Ф. Михайлова, А. Г. Сутугин, Авт. свид. СССР, № 416079, Кл. В.01j 1/14, Бюлл. изобр. № 7, 1974.
23. А.Г. Сутугин, Н.А. Фукс, Ж. прикл. механики и техн. физики, 1968, № 3, 134-143.
24. М. А. Немойтин, Тр. инст. Гипроникель, вып. 21, с. 26-31.
25. D. Beischer, A. Winkel, Naturwissenschaften, 1937, 25, 420-423.
26. Н. А. Фукс, Механика аэрозолей, Изд-во АН СССР, М., 1955.
27. J. Ph. Day, F. Basolo, R. G. Pearson, J. Amer. Chem. Soc., 1968, 90, 6927-6933.
28. А. Я. Кипнис, З. П. Федорова, Кинетика и катализ, 1978, 19, вып. 4 , с. 848-852.
29. А. Г. Сутугин, З. И. Котцев, Н. А. Фукс, Коллоидный журнал, 1971, 3З, № 4, 585-591.
30. А.Г. Сутугин, ДАН СССР, 1971, 201, № 3, 647-650.
31. А. Г. Сутугин, А. А. Лушников, Теор. основы хим. технологии, 1975, 9, № 2, 210-218.
32. G. Zebel, Staub, 1959, 19, 381-387.
33. И. М. Калитович, А. Я. Кипнис, Н. Ф. Михайлова, Д. Н. Таганов, Ж. прикл. химии, 1974, 47, № I, 43-48.
34.А.Я. Кипнис, Н.Ф. Михайлова, Совещ. по кинетике и механизму хим. реакций в твердом теле, Новосибирск, 1977, ч. I, с. 70-73.
35.А.Я. Кипнис, А.Е. Рюмшин, Депонировано в Цветметинформации, 1978 г. , № 371.
36. А.Я. Кипнис, Е.Ф. Михайлова, Л.А. Померанцева, Депонировано в ВИНИТИ, 1976 г., 32-77 Деп. 3
37. Н.А. Фукс, Успехи механики аэрозолей, ВИНИТИ, М., 1961..
38. S. J. W. Price, in: C. H. Bamford, C. F. H. Tipper (Editors), Comprehensive chemical kinetics, vol. 4, lsevier, Amsterdam, 1972, p. 200-202.
39. B. Callear, Proc. Roy. Soc. London, 1961, A265, No. 1320, 88-96.
40. W. Groth, U. Scurath, K. Weber, Z. physik. Chem. (BRD), 1974, 93, 159-171.